


分析 Ⅰ.(1)精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器有天平、药匙、玻棒、烧杯、胶头滴管、250mL容量瓶;
(2)酸化KMnO4溶液的酸本身不能具有还原性,如果有还原要被高锰酸钾氧化,本身也不能具有强氧化性,所以只能选硫酸;
(3)酸性溶液或强氧化性溶液应用酸式滴定管;
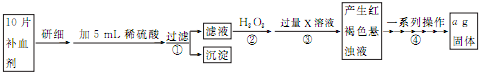
由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量;
(4)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,同时生成水;
(5)操作④是过滤得到红褐色沉淀,通过洗涤灼烧,冷却称量得到铁元素的量,计算得到补血剂中铁元素的含量;
Ⅱ(1)步骤2中加入过量铁粉防止Fe2+被氧化为Fe3+.溶液趁热过滤防止溶液冷却时,硫酸亚铁因析出而损失.
(2)加入(NH4)2SO4固体后,溶液表面出现晶膜时,停止加热,采取蒸发浓缩、冷却结晶方法,通过减压过滤(或抽滤)等得到较为干燥的晶体;
解答 解:(1)精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器有天平、药匙、玻棒、烧杯、胶头滴管、250mL容量瓶;
故答案为:250mL容量瓶;
(2)酸化KMnO4溶液的酸本身不能具有还原性,如果有还原性要被高锰酸钾氧化,本身也不能具有强氧化性,所以只能选硫酸,故答案为:A;
(3)酸性溶液或强氧化性溶液应用酸式滴定管,故答案为:B;
由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量;
(4)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,同时生成水,反应离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O,若去掉步骤②,二价铁与碱反应后在空气中加热不能得到纯净的氧化铁,无法准确计算出铁的含量,
故答案为:否,二价铁与碱反应后在空气中加热不能得到纯净的氧化铁,无法准确计算出铁的含量;
(5)操作④是过滤得到红褐色沉淀,通过洗涤、灼烧,冷却、称量得到铁元素的量,计算得到补血剂中铁元素的含量,
故答案为:灼烧;
Ⅱ、(1)步骤2中加入过量铁粉防止Fe2+被氧化为Fe3+.溶液趁热过滤防止溶液冷却时,硫酸亚铁因析出而损失;
故答案为:应该铁屑过量,否则溶液中可能有Fe3+存在;减少溶质损失;
(2)加入(NH4)2SO4固体后,溶液表面出现晶膜时,停止加热,采取蒸发浓缩、冷却结晶方法,通过减压过滤(或抽滤)等得到较为干燥的晶体,硫酸亚铁铵晶体不溶于乙醇,可以用乙醇洗去晶体表面的水;
故答案为:浓缩至液体表面出现晶膜;硫酸亚铁铵晶体不溶于乙醇,乙醇可以除去其表面的水分;
点评 本题考查了实验步骤的分析判断,物质制备的实验设计方法,性质验证,晶体析出方法的应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 增加Fe2O3的量 | B. | 增加Fe的量 | ||
| C. | 充入N2,保持容器内压强不变 | D. | 充入N2,保持容器内体积不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量相等,密度不等的N2和C2H4两种气体含有的分子数一定相等 | |
| B. | 同温同压下,等体积的H2和He气含有的质子数相等 | |
| C. | 某物质经分析仅含一种元素,此物质可能是纯净物也可能是混合物 | |
| D. | FeCl3溶液呈电中性,Fe(OH)3胶体带有电荷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com