
| A. | $\frac{1000aρ}{(50a+m)}$ mol/L | B. | $\frac{aρ}{(46a+m)}$ mol/L | ||
| C. | $\frac{1000aρ}{(46a+m)}$ mol/L | D. | $\frac{1000aρ}{(47a+m)}$ mol/L |
分析 将物质的量均为a mol的钠和铝投入足量水中发生反应:2Na+2H2O=2NaOH+H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,由方程式可知,溶液为偏铝酸钠溶液,偏铝酸钠的物质的量为amol.根据方程式计算生成氢气的物质的量,在计算氢气质量,溶液质量为m(溶液)=m(金属)+m(H2O)-m(H2),据此计算溶液质量,利用V=$\frac{m}{ρ}$计算溶液体积,再利用c=$\frac{n}{V}$计算溶液物质的量浓度.
解答 解:钠和铝投入足量水中发生反应:2Na+2H2O=2NaOH+H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,由方程式可知,a mol的钠反应生成amol氢氧化钠,生成氢气0.5amol;amol氢氧化钠与amol铝恰好反应生成amol偏铝酸钠,同时生成氢气1.5amol.溶液为偏铝酸钠溶液,所以氢气的质量为(0.5amol+1.5amol)×2g/mol=4ag;所以溶液质量m(溶液)=m(金属)+m(H2O)-m(H2)=amol×23g/mol+amol×27g/mol+mg-4ag=(46a+m)g,
所以溶液的体积为$\frac{(46a+m)g}{ρg/ml}$=$\frac{46a+m}{ρ}$ml
所以溶液的物质的量浓度为$\frac{amol}{\frac{46a+m}{ρ}×1{0}^{-3}L}$=$\frac{1000ρa}{46a+m}$mol/L.
故选:C.
点评 本题考查物质的量浓度的计算,难度中等,判断溶液是偏铝酸钠是解题关键,然后利用物质的量浓度定义式计算.理解物质的量浓度的概念.


科目:高中化学 来源: 题型:解答题
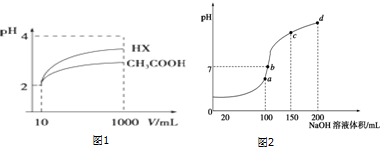
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

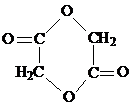 .
.


 (任写其中一种).
(任写其中一种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸钡不溶于水,所以硫酸钡是非电解质 | |
| B. | 二氧化碳溶于水可以导电,所以,二氧化碳是电解质 | |
| C. | 固态磷酸是电解质,所以磷酸在熔化时或溶于水时都能导电 | |
| D. | 液态氯化氢不能导电,但氯化氢是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将铜丝放在火焰上烧热,迅速插入乙醇中,可观察到铜丝表面由黑色变为红色,反复操作几次.还能闻到刺激性气味 | |
| B. | 向鸡蛋清溶液屮加入饱和硫酸铵溶液,有白色固体析出,再加入蒸馏水,振荡,固体又重新溶于水 | |
| C. | 向淀粉溶液中加入少量稀硫酸,加热4~5 min,待溶液冷却后,加入少量碘水,溶液呈蓝色,说明淀粉没有水解 | |
| D. | 取5mL0.1 mol•L-1 FeCl3,溶液,滴加0.1 mol•L1 KI溶液5~6滴,振荡,再加入少量KSCN溶液,溶液呈红色,说明该反应有一定的限度 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com