
| A. | 加成→消去→取代 | B. | 消去→加成→取代 | C. | 取代→消去→加成 | D. | 消去→加成→消去 |
分析 由2-氯丙烷制取少量1,2-丙二醇,应先发生氯代烃的消去反应,再发生加成反应引入两个氯原子,然后发生水解即可得到1,2-丙二醇.
解答 解:由2─氯丙烷制取少量1,2─丙二醇,应先发生在NaOH/醇条件下氯代烃的消去反应,CH3CHClCH3$→_{醇}^{NaOH}$CH2=CH2CH3,
再发生加成反应引入两个氯原子,发生CH2=CH2CH3+Cl2$\stackrel{催化剂}{→}$ClCH2CHClCH3,
然后发生水解即可得到1,2─丙二醇,发生ClCH2CHClCH3+2H20$\stackrel{NaOH}{→}$OHCH2CHOHCH3,故选B.
点评 本题主要考查有机物的合成,明确官能团的变化及物质的性质来分析合成方法是解答本题的关键,题目难度不大.


 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三上学期第13次周测理科综合化学试卷 题型:实验题
硫化亚铁煅烧得到的烧渣的主要成分为FeO、Fe3O4和Fe2O3等。利用该烧渣制备铁红和副产品无氯钾肥的流程如下:
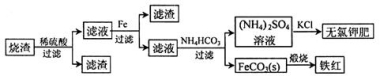
回答下列问题:
(1)煅烧硫化亚铁若生成Fe2O3和SO2,则生成标准状况下11.2L SO2气体,转移电子的物质的量为____________。
(2)该流程中加入铁粉的作用是____________(用离子方程式表示)。
(3)已知四种盐的溶解度随温度变化的曲线如图所示。请回答下列问题:
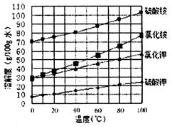
①向滤液II中加入NH4HCO3溶液所发生反应的离子方程式是________________。
②向(NH4)2SO4溶液加入KCl后得到无氯钾肥应进行的操作为_________、________、洗涤、干燥等;反应的化学方程式为_______________。
(4)用含少量硫酸亚铁和硫酸铁的硫酸铜溶液制备CuSO4·5H2O的流程如下:
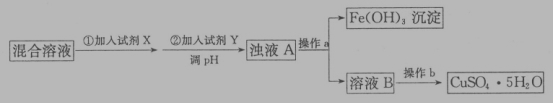
加入试剂X的目的是_____,调节溶液pH的试剂Y可能是_____(填字母编号)。
a.NaOH
b.CuO
c.NH3·H2O
d.Cu(OH)2CO3
Cu2+为0.2mol·L-1的溶液,欲除尽Fe3+(当离子浓度小于1*10-5mol·L-1时,离子已沉淀完全,)调整溶液pH的精确范围是_____(已知:Kap[Cu(OH)2]=2×10-20,Kap[Fe(OH)3]=8.0×10-38,lg2=0.3)。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | X、Y元素能与氢形成分子式为H2XY2、H4X2Y2等弱酸 | |
| B. | 化合物ZY2中只含有离子键 | |
| C. | 工业上可用X单质置换ZY得到Z单质 | |
| D. | Y的氢化物的沸点比其下一周期的同族元素的氢化物的沸点低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com