

 .
. 分析 短周期元素A、B、C、D、E的原子序数依次增大,A元素的最高正化合价和最低负化合价的绝对值之差为2,可知最外层电子数为5,应为N元素;1mol C单质与冷水反应,在标准状况下生成11.2L H2,C为Na元素;D原子最外层电子数等于其周期序数,D为Al;E-的电子层结构与Ar原子相同,E为Cl元素;B和E同主族,则B为F元素,以此解答该题.
解答 解:短周期元素A、B、C、D、E的原子序数依次增大,A元素的最高正化合价和最低负化合价的绝对值之差为2,可知最外层电子数为5,应为N元素;1mol C单质与冷水反应,在标准状况下生成11.2L H2,C为Na元素;D原子最外层电子数等于其周期序数,D为Al;E-的电子层结构与Ar原子相同,E为Cl元素;B和E同主族,则B为F元素.
(1)D为铝元素,E为氯元素,故答案为:铝;氯;
(2)同周期自左而右原子半径减小、同主族自上而下原子半径增大,故五种元素对应的原子半径最小的是 F,电子层结构相同核电荷数越大离子半径越小、离子电子层越多离子半径越大,故Cl-离子半径最大,
故答案为:F;Cl;
(3)A的单质为N2,电子式为  ,故答案为:
,故答案为: ;
;
(4)C和B形成化合物为NaF,用电子式表示形成过程: ,
,
故答案为: .
.
点评 本题考查位置结构性质相互关系及应用,侧重对元素周期律与电子式的考查,注意掌握电子式表示化学键或物质的形成过程.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S2-的结构示意图: | |
| B. | 质子数为38,中子数为50的Sr原子:5038Sr | |
| C. | NH4Cl的电子式: | |
| D. | PBr3的结构式: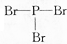 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用图1装置蒸发FeCl3溶液制备无水FeCl3 | |
| B. | 用图2装置电解精炼铝 | |
| C. | 用图3装置乙醇脱水制乙烯 | |
| D. | 用图4装置定量测定化学反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2既是氧化产物又是还原产物 | |
| B. | NH4+部分被氧化 | |
| C. | 氧化产物和还原产物的物质的量比为3:1 | |
| D. | 氧化产物和还原产物的物质的量比为1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 .关于它的说法中,正确的是( )
.关于它的说法中,正确的是( )| A. | 青蒿素是一种氧化物 | |
| B. | 青蒿素中氧元素的质量分数为11.9% | |
| C. | 青蒿素中C、H、O三种元素的质量比为90:11:40 | |
| D. | 青蒿素是由15个碳原子、22个氢原子和5个氧原子构成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 | |
| B. | 28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA | |
| C. | 甲烷和氯气反应生成一氯甲烷与苯和硝酸反应生成硝基苯的反应类型相同 | |
| D. | 苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com