


分析 (1)结合氧化还原反应电子守恒,物质的量之比1:1的NO和NO2混合气体与NaOH溶液反应,发生氧化还原反应生成NaNO2,NO中氮元素化合价+2价变化为+3价,NO2中 但元素化合价+4价变化为+3价,化合价降低值=化合价升高值=转移电子数,据此计算电子转移总数e-;
(2)①只有N元素的化合价变化,氧化还原反应中,元素化合价降低的物质做氧化剂,元素化合价升高的物质最还原剂;
②安全气囊容积为56L,气囊中充满标准状况下氮气,氮气的物质的量为$\frac{56L}{22.4L/mol}$=2.5mol,结合10NaN3+2KNO3$\frac{\underline{\;撞击\;}}{\;}$K2O+5Na2O+16N2↑及m=nM计算.
解答 解:(1)物质的量之比1:1的NO和NO2混合气体与NaOH溶液反应,发生氧化还原反应生成NaNO2,由电子及原子守恒可知反应为NO+NO2+2NaOH=2NaNO2+H2O,NO中氮元素化合价+2价变化为+3价,NO2中 但元素化合价+4价变化为+3价,化合价降低值=化合价升高值=转移电子数,据此计算电子转移总数e-;单线桥标注电子转移为:
故答案为: ;
;
(2)①10NaN3+2KNO3$\frac{\underline{\;撞击\;}}{\;}$K2O+5Na2O+16N2↑,反应中氮元素化合价-$\frac{1}{3}$价变化为0价,+5价变化为0碱,所以元素化合降低的物质做氧化剂,KNO3为氧化剂,元素化合价升高的做还原剂,NaN3做还原剂,
故答案为:KNO3;NaN3;
②n(N2)=$\frac{56L}{22.4L/mol}$=2.5mol
设该安全气囊反应生成的K2O质量为 x,Na2O质量为x,则:
10NaN3+2KNO3$\frac{\underline{\;撞击\;}}{\;}$K2O+5Na2O+16N2↑
94 310 16mol
x y 2.5mol
x=14.7g;
y=48.4g,
安全气囊中生成的K2O和Na2O的总质量为63.1克,
答:该安全气囊中生成的K2O和Na2O的总质量为63.1克
点评 本题以物质的制备考查氧化还原反应及计算、混合物分离提纯等,注重高频考点的考查,侧重化学反应原理应用及计算能力的考查,题目难度中等.


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:多选题
| A. |  =KCl+3Cl2↑+3H2O =KCl+3Cl2↑+3H2O | |
| B. | H2S+H2SO4(浓)═S↓+SO2↑+2H2O | |
| C. | 2H2S+SO2═3S↓+2H2O中氧化剂与还原剂的物质的量之比是1:2 | |
| D. | 3NO2+H2O═2HNO3+NO中氧化剂与还原剂的物质的量之比是1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
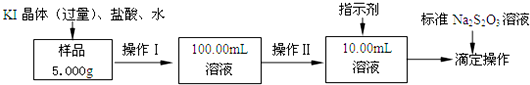
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
| ① | 50.0 | 2.0 | 薄片 | 15 | 200 | m1 |
| ② | 50.0 | 2.0 | 薄片 | 25 | 100 | m2 |
| ③ | 50.0 | 2.0 | 颗粒 | 25 | 70 | m3 |
| ④ | 50.0 | 2.0 | 颗粒 | 35 | 35 | m4 |
| ⑤ | 50.0 | 2.0 | 粉末 | 25 | t1 | 5.0 |
| ⑥ | 50.0 | 4.0 | 粉末 | 25 | t2 | m5 |
| ⑦ | 50.0 | 6.0 | 粉末 | 25 | t3 | 14.9 |
| ⑧ | 50.0 | 8.0 | 粉末 | 25 | t4 | 19.3 |
| ⑨ | 50.0 | 10.0 | 粉末 | 25 | t5 | m6 |
| ⑩ | 50.0 | 12.0 | 粉末 | 25 | t6 | 19.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
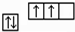 ;其2p能级的轨道有3个伸展方向,电子云的形状为纺锤形.
;其2p能级的轨道有3个伸展方向,电子云的形状为纺锤形.
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
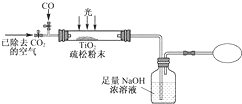
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 ,由上述实验可知,该溶液中可以肯定存在的离子有SO32-、S2-、CO32-.
,由上述实验可知,该溶液中可以肯定存在的离子有SO32-、S2-、CO32-.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com