
| A. | Na+ | B. | H+ | C. | SO42- | D. | NH4+ |
科目:高中化学 来源: 题型:选择题
| A. | 1molSO2(g)的能量总和大于lmolS(s)和lmolO2(g)的能量总和 | |
| B. | 将2molSO2(g)与lmolO2(g)在一定条件下充分反应,放出196.6kJ的热量 | |
| C. | S(g)+O2(g)→SO2(g)+Q,Q值小于297.16kJ | |
| D. | 当lmolS(s)完全转化为SO3(g)时(假设无热量损失),放出395.46kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑥⑤④⑧⑦⑨ | B. | ①②⑤③⑥④⑧⑦⑨ | C. | ①②③④⑤⑧⑥⑦⑨ | D. | ①②③⑤⑥④⑧⑦⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 若I中装过量高锰酸钾溶液,Ⅱ中装澄清石灰水,则能检验SO2中是否混有CO2 | |
| B. | 若I中装足量澄清石灰水,Ⅱ中装浓硫酸,则能测定CO2和水蒸气的混合气体中水蒸气的含量 | |
| C. | 若I中装足量饱和碳酸钠溶液,Ⅱ中装浓硫酸,则能除去CO2中混有的HCl | |
| D. | 若I中装BaCl2溶液,Ⅱ中装水,则能证明SO2和NO2混合气体中SO2不与BaCl2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
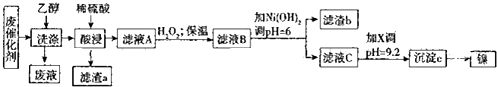
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
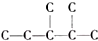 ,此烷烃的一溴代物有6 种,若此烷烃为炔烃加氢制得,则此炔烃的结构简式为(CH3)2CH(CH3)CHC≡CH.
,此烷烃的一溴代物有6 种,若此烷烃为炔烃加氢制得,则此炔烃的结构简式为(CH3)2CH(CH3)CHC≡CH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯甲酸钠是一种常见的食品防腐剂.实验室制备苯甲酸的反应装置图和有关数据如下:
苯甲酸钠是一种常见的食品防腐剂.实验室制备苯甲酸的反应装置图和有关数据如下:| 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | |
| 甲苯 | 92 | -94.9 | 110.6 | 难溶于水 |
| 苯甲酸 | 122 | 122.13 | 249 | 微溶于水 |
| 苯甲酸钠 | 144 | - | 249.3 | 易溶于水 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 呵护生存环境,共建和谐社会是当今社会的主题.
呵护生存环境,共建和谐社会是当今社会的主题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 变小 | B. | 不变 | ||
| C. | 增大 | D. | 可能增大、减小,也可能不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com