
【题目】肼可作为火箭发动机的燃料,与N2O4反应生成N2和水蒸气。已知:
①N2(g)+2O2(g) =N2O4(l) ΔH1=-19.5 kJ·mol-1
②N2H4(l)+O2(g) = N2(g)+2H2O(g) ΔH2=-534.2 kJ·mol-1
(1)写出肼和N2O4反应的热化学方程式______________;
(2)上述反应中氧化剂是______________。
(3)火箭残骸中常现红棕色气体,当温度升高时,气体颜色变深,原因是存在如下反应:N2O4 (g) ![]() 2NO2 (g)
2NO2 (g)
① 上述反应的ΔH_________0(选填“>”或“<”)。
② 保持温度和体积不变向上述平衡体系中再充入一定量的N2O4,再次达到平衡时,混合气体中NO2的体积分数_______(填“增大”、“ 减小”或“不变”),混合气体的颜色_______(填“变深”或“变浅”)。
③一定温度下,将1 mol N2O4 充入一恒压密闭容器中发生上述反应,下列示意图正确且能说明反应达到平衡状态的是___________。
④若在相同温度下,上述反应改在体积为10L的恒容密闭容器中进行,反应3s后NO2的物质的量为0.6mol,则0-3s内的平均反应速率v(N2O4)=___________ mol·L-1·s-1。
【答案】 2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)ΔH=-1048.9kJ/mol N2O4 > 减小 变深 ad 0.01
【解析】(1)肼可作为火箭发动机的燃料,与氧化剂N2H4反应生成N2和水蒸气,将方程式②×2-①得肼和N2H4反应的热化学方程式,2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-1048.9kJ/mol,故答案为:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-1048.9kJ/mol;
(2)根据(1)中反应2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)可知,N2O4中的氮元素从+4价变为0价,所以N2O4是氧化剂,故答案为:N2O4;
(3)①升高温度,化学平衡向吸热反应方向移动,当温度升高时,气体颜色变深,平衡向正反应方向移动,所以正反应是吸热反应即△H>0,故答案为:>;
②保持温度和体积不变向上述平衡体系中再充入一定量的N2O4,相对于成比例增大反应物,即增大压强平衡向气体体积减小的方向移动即逆反应方向,所以NO2的体积分数减小,但二氧化氮的浓度仍然增大,则混合气体的颜色变深,故答案为:减小;变深;
③a、反应方程式两边气体的质量不相等,密度不变,说明达到了平衡状态,故a正确;b、反应过程中,反应热不会变化,不是变量,无法判断是否达到平衡状态,故b错误;c、根据图像,正反应速率还在减小,则说明未达到平衡状态,故c错误;d、四氧化二氮的转化率不变,说明正逆反应速率相等,达到了平衡状态,故d正确;故选ad;
④v(NO2)=v(NO2)= ![]() =
=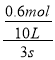 =0.02mol/Ls,则v(N2O4)=
=0.02mol/Ls,则v(N2O4)= ![]() v(NO2)=0.01mol/(Ls),故答案为:0.01。
v(NO2)=0.01mol/(Ls),故答案为:0.01。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】有两个密闭容器A和B,A容器中有一个移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等量的体积比为2:l的SO2和O2的混合气体,并使A和B容积相等(如图所示),在保持400℃的温度下使之发生如下反应:2SO2+O2![]() 2SO3。填写下列空白:
2SO3。填写下列空白:
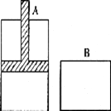
(1)SO2的转化率α(A)______α(B)。(填“<”、“>”或“=”)
(2)达到(1)所述平衡时,若向两容器中通入少量的氩气,A容器化学平衡_________移动。(填“正向”、“逆向”或“不”)
(3)达到(1)平衡后,向容器中充入等量的原反应气体,再次达到平衡后,B容器中SO3在混合气体中的体积分数_______。(填“增大”、“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Mg2C3的结构与CaC2的结构相似.由此可断定Mg2C3与水反应的产物是( )
A.Mg(OH)2和CH≡CH
B.MgO和CH≡CH
C.Mg(OH)2和CH3CH=CH2
D.Mg(OH)2和CH3C≡CH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2SO2(g)+O2(g)![]() 2SO3(g) △H=-197kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲)2molSO2和lmolO2;(乙) lmolSO2和0.5molO2;(丙)2 mol SO3。恒温、恒容下反应达平衡时,下列关系一定正确的是
2SO3(g) △H=-197kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲)2molSO2和lmolO2;(乙) lmolSO2和0.5molO2;(丙)2 mol SO3。恒温、恒容下反应达平衡时,下列关系一定正确的是
A. 容器内压强P:P甲=P丙>2P乙
B. SO3的质量m:m甲=m丙>2m乙
C. c(SO2)与c(O2)之比 k:k甲=k丙>k乙
D. 反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A.乙醇能与钠单质反应说明乙醇属于电解质
B.一般动物脂肪分子中碳碳双键的含量低于植物油分子
C.用小苏打溶液可以区分乙醇、乙酸乙酯和苯
D.在溴化铁的催化作用下,苯与溴水混合易发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体的叙述不正确的是
A. 胶体分散质的微粒直径在10-9 —10-7m之间
B. 用平行光照射胶体时,能产生丁达尔现象
C. 明矾产生的氢氧化铝胶体能够吸附水中杂质,达到净水目的
D. Fe(OH)3胶体是纯净物,能全部透过滤纸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.乙醇和二氯甲烷都存在同分异构体
B.油脂在碱性条件下才能水解
C.制聚乙烯塑料的反应属于取代反应
D.高温消毒是利用蛋白质变性的原理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“玉兔”号月球车用 ![]() Pu作为热源材料.下列关于
Pu作为热源材料.下列关于 ![]() Pu的说法正确的是( )
Pu的说法正确的是( )
A.![]() Pu与
Pu与 ![]() U互为同位素
U互为同位素
B.![]() Pu与
Pu与 ![]() Pu互为同素异形体
Pu互为同素异形体
C.![]() Pu与
Pu与 ![]() U具有完全相同的化学性质
U具有完全相同的化学性质
D.![]() Pu与
Pu与 ![]() Pu具有相同的最外层电子数
Pu具有相同的最外层电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.能量之间可相互转化:电解食盐水制备氯气是将电能转化为化学能,而原电池可将化学能转化为电能。设计两种类型的原电池,探究其能量转化效率。
限选材料:ZnSO4(aq),FeSO4 (aq),CuSO4 (aq);铜片,铁片,锌片和导线
(1)完成原电池甲的装置示意图,并作相应的标注。要求:在同一烧杯中,电极与溶液含相同的金属元素。_____________
(2)以铜片为电极之一,硫酸铜溶液为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时间后,可观察到负极________________
(3)甲乙两种原电池中可更有效地将化学能转化为电能的是____________,其原因是_________________________
(4)根据牺牲阳极的阴极保护法原理,为了减缓电解质溶液中铁片的腐蚀,在上述的材料中应选__________作阳极。
Ⅱ. CO与H2反应还可制备C2H5OH,C2H5OH可作为燃料使用,用C2H5OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:
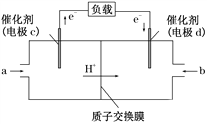
电池总反应为C2H5OH+3O2===2CO2+3H2O,则d电极是________(填“正极”或“负极”),c电极的反应方程式为_______________________________。若线路中转移2 mol电子,则上述燃料电池,消耗的O2在标况下的体积为______ L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com