
分析 C与E、D与E产生气体,五种物质中,能与两种物质的产生气体的只有K2CO3,则E为K2CO3,则C、D为HNO3、HCl中的物质,而D与B能产生沉淀,则D为HCl,能与硝酸银产生AgCl沉淀,所以C为HNO3,B为AgNO3,则A为BaCl2,结合物质的性质,可写出反应的离子方程式,以此解答该题.
解答 解:(1)C与E、D与E产生气体,五种物质中,能与两种物质的产生气体的只有K2CO3,则E为K2CO3,则C、D为HNO3、HCl中的物质,而D与B能产生沉淀,则D为HCl,能与硝酸银产生AgCl沉淀,所以C为HNO3,B为AgNO3,则A为BaCl2,
故答案为:BaCl2;AgNO3;HNO3;HCl;K2CO3;
(2)B为AgNO3,E为K2CO3,二者反应生成Ag2CO3,反应的离子方程式为2Ag++CO32-=Ag2CO3↓,故答案为:2Ag++CO32-=Ag2CO3↓.
点评 本题考查无机物的推断以及离子方程式的书写,为高频考点,侧重学生的分析能力的考查,题目难度中等,解答本题时注意把握物质的性质,结合反应现象推断.


科目:高中化学 来源: 题型:选择题
 如图把气体缓慢通过盛有足量试剂的试剂瓶A,在试管B中可以观察到明显现象的是( )
如图把气体缓慢通过盛有足量试剂的试剂瓶A,在试管B中可以观察到明显现象的是( )| 选项 | 气体 | A中试剂 | B中试剂 |
| A | SO2、CO2 | 酸性KMnO4溶液 | 品红溶液 |
| B | Cl2、HCl | 浓硫酸 | KI淀粉溶液 |
| C | NH3、CO2 | 浓硫酸 | 酚酞试液 |
| D | C2H4、CH4 | 酸性KMnO4溶液 | 溴的CCl4溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 压强 温度 | 1×105Pa | 5×105Pa | 10×105Pa | 50×105Pa | 100×105Pa |
| 450℃ | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 500℃ | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
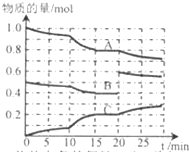 在恒定温度t℃,2L恒容密闭容器中发生反应aA(g)+bB(g)?cC(g),容器中A、B、C物质的量变化如图所示,回答下列问题:
在恒定温度t℃,2L恒容密闭容器中发生反应aA(g)+bB(g)?cC(g),容器中A、B、C物质的量变化如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

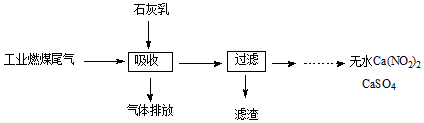
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com