
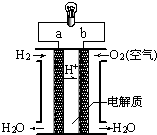
| A、a极是负极 |
| B、正极的电极反应是:O2+2H2O+4e-═4OH- |
| C、电子由a通过灯泡流向b |
| D、氢氧燃料电池是环保电池 |


 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
 前四周期原子序数依次增大的元素A、B、C、D、E中,A的基态原子核外3个能级上有电子,且每个能级上的电子数相等,B原子核外电子有7种不同的运动状态,C元素原子核外的M层中只有2对成对电子,D+与C2-的电子数相等,E元素位于元素周期表的ds区,且基态原子价层电子均已成对.
前四周期原子序数依次增大的元素A、B、C、D、E中,A的基态原子核外3个能级上有电子,且每个能级上的电子数相等,B原子核外电子有7种不同的运动状态,C元素原子核外的M层中只有2对成对电子,D+与C2-的电子数相等,E元素位于元素周期表的ds区,且基态原子价层电子均已成对.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
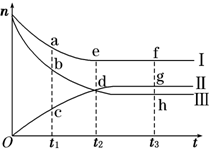 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),500K、30MPa下n(NH3)、n(H2)和n(N2)随时间变化的关系如图所示.
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),500K、30MPa下n(NH3)、n(H2)和n(N2)随时间变化的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向明矾溶液中加入足量的氢氧化钡溶液Ba2++4OH-+Al3++SO42-=BaSO4↓+AlO2-+2H2O |
| B、酸性高锰酸钾溶液与草酸溶液混合2MnO4-+5C2O42-+16H+=2Mn2++10 CO2↑+8H2O |
| C、将等物质的量浓度的氯水与FeI2溶液混合2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl- |
| D、向氢氧化钡溶液中通入足量的SO2气体OH-+SO2=HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应是复分解反应 |
| B、Na2SO3发生氧化反应 |
| C、H2SO4是氧化剂 |
| D、NaClO3是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,28 g氮气所含的原子数为2NA |
| B、22.4 L甲烷(CH4)所含的原子数为5NA |
| C、0.5 molCuO的摩尔质量为40g/mol |
| D、2L 1mol?L-1K2SO4溶液中离子的总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com