
| A. | 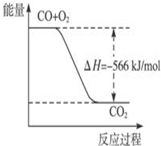 图可表示由CO生成CO2的反应过程和能量关系 | |
| B. | CO的燃烧热为566 kJ/mol | |
| C. | Na2O2(s)+CO2(s)=Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226 kJ/mol | |
| D. | CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为2×6.02×1023 |
分析 A、依据热化学方程式,2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol;分析图象中物质的量不符合反应物质物质的量;
B、依据燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出热量;
C、固体二氧化碳变化为气体二氧化碳需要吸热,焓变放热是负值;
D、依据热化学方程式,结合盖斯定律计算得到热化学方程式计算分析.
解答 解:A、由热化学方程式,2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol,可知图象中一氧化碳和氧气物质的量为1、$\frac{1}{2}$物质的量不符合反应物质的物质的量,故A错误;
B、燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出热量;已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol,一氧化碳的燃烧热为283kJ/mol,故B错误;
C、固体二氧化碳变化为气体二氧化碳需要吸热,焓变放热是负值,由2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g)△H=-226kJ/mol,故C错误;
D、已知:①2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol;
②Na2O2(s)+CO2(g)=Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ/mol
依据盖斯定律②×2+①得到:2Na2O2(s)+2CO(g)=2Na2CO3(s)△H=-1018kJ/mol;
即Na2O2(s)+CO(g)=Na2CO3(s)△H=-509kJ/mol;
CO(g)与Na2O2(s)反应放出509 kJ热量时,反应的一氧化碳物质的量为1mol,电子转移数为2×6.02×1023,故D正确.
故选:D.
点评 本题考查了热化学方程式的计算应用,盖斯定律的应用,燃烧热概念计算分析,热化学方程式的书写方法和计算应用是解题关键,题目难度中等.


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
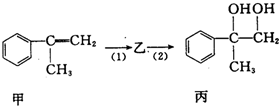
| A. | 反应(1)的无机试剂是液溴,铁作催化剂 | |
| B. | 步骤(2)产物中可能含有未反应的甲,可用酸性高锰酸钾溶液检验是否含甲 | |
| C. | 乙既能发生水解反应,又能发生消去反应 | |
| D. | 反应(1)和(2)均为取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖和蛋白质等高分子化合物是人体必需的营养物质 | |
| B. | 将草木灰和硫酸铵混合施用,肥效更高 | |
| C. | 用二氧化碳生产聚碳酸酯可以减少碳排放,以减缓温室效应 | |
| D. | 棉花的主要成分是纤维素,石英玻璃、陶瓷和水泥均属于硅酸盐产品 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
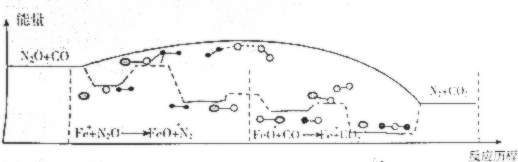
| A. | N2O与CO反应的△H<0 | |
| B. | FeO+也是该反应的催化剂 | |
| C. | Fe+使该反应的活化能减小 | |
| D. | Fe++N2O→FeO++N2、FeO++CO→Fe++CO2两步反应均为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
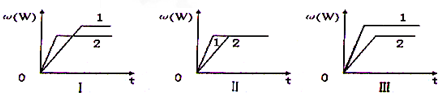
| A. | 图I可能是不同压强对反应的影响,且p2>p1,a+b>n | |
| B. | 图I可能是不同温度对反应的影响,且T2>T1,△H>0 | |
| C. | 图II可能是不同压强对反应的影响,且p1>p2,n=a+b | |
| D. | 图Ⅲ可能是不同温度对反应影响,且T1>T2,△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠的电子式: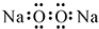 | |
| B. | 乙醇的分子式:C2H5OH | |
| C. | 硫离子的结构示意图: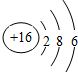 | |
| D. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{80}$Br |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(A)=0.6 mol/(L•s) | B. | V(B)=0.4 mol/(L•s) | C. | V(C)=0.7 mol/(L•s) | D. | V(D)=1 mol/(L•s) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com