将0.4molNaHCO3和0.3molNa2O2的混和物共57.0g放在一密闭体积可变的容器中充分加热.写出NaHCO3分解以及分解产物与Na2O2反应的化学议程式,并用化学方程式计算
(1)恢复到室温后得到气体在标准状况下的体积
(2)(2分)恢复到室温后得到固体物质的质量(常温下水与Na2CO3会生成十水合碳酸钠)为______g.
【答案】
分析:反应的方程式有:2NaHCO
3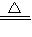
Na
2CO
3+CO
2↑+H
2O,2Na
2O
2+2CO
2=2Na
2CO
3+O
2,2Na
2O
2+2H
2O=4NaOH+O
2↑,根据各物质的量结合方程式计算.
解答:解:(1)将0.4molNaHCO
3和0.3molNa
2O
2的混和物共57.0g放在一密闭体积可变的容器中充分加热,发生反应有:
2NaHCO
3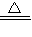
Na
2CO
3+CO
2↑+H
2O,2Na
2O
2+2CO
2=2Na
2CO
3+O
2,2Na
2O
2+2H
2O=4NaOH+O
2↑,则
2NaHCO
3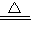
Na
2CO
3+CO
2↑+H
2O
0.4mol 0.2mol 0.2mol
2Na
2O
2+2CO
2=2Na
2CO
3+O
20.2mol 0.2mol 0.1mol
2Na
2O
2+2H
2O=4NaOH+O
2↑
0.1mol 0.1mol 0.05mol
n(O
2)=0.1mol+0.05mol=0.15mol,
V(O
2)=0.15mol×22.4L/mol=3.36L,
答:恢复到室温后得到气体在标准状况下的体积为3.36L.
(2)由(1)反应可知:
n(Na
2CO
3)=0.2mol+0.2mol=0.4mol,
n(NaOH)=0.2mol,
n(H
2O)=0.1mol,
则:m(Na
2CO
3)=0.4mol×106g/mol=42.4g,
m(NaOH)=0.2mol×40g/mol=8g,
m(H
2O)=0.1mol×18g/mol=1.8g,
因部分Na
2CO
3和水反应生成Na
2CO
3?10H
2O,所以反应恢复到室温后得到固体物质为Na
2CO
3和NaOH以及Na
2CO
3?10H
2O,
固体的质量为:m(Na
2CO
3)+m(NaOH)+m(H
2O)=42.4g+8g+1.8g=52.2g,
故答案为:52.2.
点评:本题考查混合物的计算,题目难度中等,注意相关反应方程式的书写,把握根据方程式计算的方法.

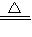 Na2CO3+CO2↑+H2O,2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,根据各物质的量结合方程式计算.
Na2CO3+CO2↑+H2O,2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,根据各物质的量结合方程式计算.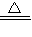 Na2CO3+CO2↑+H2O,2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,则
Na2CO3+CO2↑+H2O,2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,则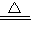 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
