
| A�� | ���е����ʵ�����Ba��OH��2��KOH���Ļ����Һ��ͨ��CO2����CO2��Ӧ������������KOH��Ba��OH��2��BaCO3 | |
| B�� | ���е����ʵ�����Fe2+��Ag+��Cu2+ �Ļ����Һ�м���Zn����Zn��Ӧ������������Ag+��Cu2+��Fe2+ | |
| C�� | ���е����ʵ�����AlO2?��OH-��CO32- �Ļ����Һ�еμ���������ᷴӦ������������AlO2-��Al��OH��3��OH-��CO32- | |
| D�� | ���е����ʵ�����AlCl3��HCl�Ļ����Һ�еμ�NaOH��Һ����NaOH��Ӧ������������AlCl3��HCl��Al��OH��3 |
���� A���ȷ�����������CO2��Ӧ�ٷ���OH-��CO2��Ӧ��
B��������Խǿ��������Zn��Ӧ��
C�������Ⱥ����������ӷ�Ӧ��
D������ǿ������NaOH��Ӧ��
��� �⣺A���������ʵ�����Ba��OH��2��KOH����Һ��ͨ��CO2���Ⱥ�˳��ΪBa��OH��2��KOH��BaCO3����A����
B��������ΪAg+��Cu2+��Fe2+�������Zn����Zn��Ӧ������������Ag+��Cu2+��Fe2+����B��ȷ��
C���������ʵ�����AlO2-��OH-��CO32-����Һ�У���μ������ᣬ��Ӧ���Ⱥ�˳��ΪOH-��AlO2-��CO32-��Al��OH��3����C����
D�����е����ʵ�����AlCl3��HCl�Ļ����Һ�еμ�NaOH��Һ����NaOH��Ӧ������������HCl��AlCl3��Al��OH��3����D����
��ѡB��
���� ���⿼�黯ѧʵ�鷽�������ۣ�Ϊ��Ƶ���㣬�漰������ԭ��Ӧ�������йص����ӷ�Ӧ�ȣ��������ʵ����ʡ���Ӧ���Ⱥ�˳��Ϊ���Ĺؼ������ط�����Ӧ�������Ŀ��飬��Ŀ�ѶȲ���


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ʵ����� | ���� | ���ͻ���� |
| A | ��SO2ͨ����ɫʯ����Һ�� | ��ɫ��ȥ | SO2����Ư���� |
| B | ��Ũ����ε�pH��ֽ�� | ��ֽ��� | Ũ����������� |
| C | ������NO2���ܱղ������������ˮ�� | ����ɫ���� | ��Ӧ2NO2?N2O4 �ġ�H��0 |
| D | �����ھƾ��ƻ����ϼ��� | �����ۻ��������� | ���������������۵������ |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
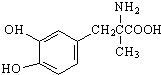
| A�� | 1 mol����͵ķ����к���4 mol˫�� | |
| B�� | ÿ������ͷ����к���һ������̼ԭ�� | |
| C�� | 1 mol������������2 mol Br2����ȡ����Ӧ | |
| D�� | ����ͼ��������ᷴӦ������������������Һ��Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | ������м��ٵ�3 g����һ���ǻ���� | |
| B�� | ��������������ٵĹ�������һ����Fe2O3 | |
| C�� | ���������������Եó���ɫ��Һ��n��Cu2+��=0.02 mol | |
| D�� | ���ݲ��������ж�X������������������Ϊ50% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
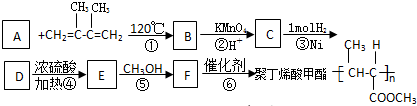
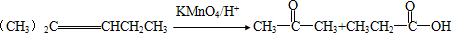

 ��D
��D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| A | A��һ�ֵ�������Ȼ����Ӳ����� |
| B | BԪ�صĵ�һ�����ܱ�ͬ������������Ԫ�ض��� |
| C | ͬ�����У�CԪ�ص�����������Ӧ��ˮ����ļ�����ǿ |
| D | D�Ļ�̬ԭ��M���������K���2 �� |
| E | E��Cλ�ڲ�ͬ���ڣ�Eԭ�Ӻ���������������C��ͬ�����������Ӿ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | W������������SiO2�������������� | |
| B�� | ֻ��X��Y��Z����Ԫ�ص�ijˮ��Һһ�������� | |
| C�� | ��X��M��Z�γɵĻ�����X2Z2��M2Z2�������Ļ�ѧ��������ͬ | |
| D�� | M�ĵ��ʿ����ڴ��ѡ�ﯵȽ������Ȼ������Ʊ��ѡ�ﯵȵ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��X��Y��Z��W��P��Q����ǰ�����ڵ�����Ԫ�أ�ԭ�������������۵�����֮��Ϊ26��ԭ�Ӱ뾶��Y��Z��W��P��Q��X���μ�С��Χ������Ԫ�أ��ش��������⣺
��X��Y��Z��W��P��Q����ǰ�����ڵ�����Ԫ�أ�ԭ�������������۵�����֮��Ϊ26��ԭ�Ӱ뾶��Y��Z��W��P��Q��X���μ�С��Χ������Ԫ�أ��ش��������⣺ ��YQ3����ԭ�ӵ��ӻ�����Ϊsp2��Z��Q��Ԫ�ص�һ�����ܵĴ�С��ϵ��Z��Q�����������������=������
��YQ3����ԭ�ӵ��ӻ�����Ϊsp2��Z��Q��Ԫ�ص�һ�����ܵĴ�С��ϵ��Z��Q�����������������=������ ������ˮ��Ӧ�Ļ�ѧ����ʽΪNH4H+H2O=NH3•H2O+H2����
������ˮ��Ӧ�Ļ�ѧ����ʽΪNH4H+H2O=NH3•H2O+H2�����鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com