
下列不能说明氯的非金属性比硫强的事实是( )
①HCl比H2S稳定 ②HClO氧化性比H2SO4强 ③HClO4酸性比H2SO4强 ④Cl2能与H2S反应生成S ⑤在与钠反应时,S原子得到的电子数更多 ⑥C l2与Fe反应生成FeCl3,S与Fe反应生成FeS ⑦HCl酸性比H2S强
l2与Fe反应生成FeCl3,S与Fe反应生成FeS ⑦HCl酸性比H2S强
A.②⑤⑦ B.①②⑦ C.②⑤⑥ D. ③④⑤
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
下列关于有机化合物的说法中,正确的是( )
A.凡是含碳元素的化合物都属于有机化合物
B.易溶于汽油、酒精、苯等有机溶剂的物质一定是有机化合物
C.所有的有机化合物都很容易燃烧
D.有机化合物的同分异构现象是有机物种类繁多的重要原因之一
查看答案和解析>>
科目:高中化学 来源: 题型:
将NaClO3和Na2SO3按物质的量比2:1加入烧瓶中,再滴入少量H2SO4溶液并用水溶解、加热,产生棕黄色气体X,反应后测得NaClO3和Na2SO3恰好完全反应.则X为( )
|
| A. | ClO2 | B. | Cl2O | C. | Cl2 | D. | Cl2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于卤族元素和碱金属性质的叙述中,不正确的是 ( )
A. 卤素单质的熔点和沸点随核电荷数的增加逐渐升高
B. 碱金属单质与水反应生成碱和氢气
C. 碱金属单质在空气中燃烧都可生成过氧化物
D. 卤素的氢化物的还原性性随核电荷数的增加逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.检测乙醇中是否含有水可加入少量的无水硫酸铜,如变蓝则含水
B.除去乙醇中的微量水可加入金属钠,使其完全反应
C.获得无水乙醇的方法通常采用先用浓H2SO4吸水,然后再加热蒸馏的方法
D.获得无水乙醇的方法通常采用先用生石灰吸水,然后再加热蒸馏的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混合气体,假定氯气在水中的溶解度可以忽略。将封闭有甲烷和氯气的混合气体的装置放置在有光亮的地方,让混合气体缓慢地反应一段时间。
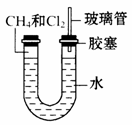 (1)假设甲烷与氯气反应充分,且只产生一种有机物,请写出化学方程式:____________________________________________。
(1)假设甲烷与氯气反应充分,且只产生一种有机物,请写出化学方程式:____________________________________________。
(2)经过几个小时的反应后,U形管右端的玻璃管中水柱变化是 。
A.升高 B.降低 C.不变 D.无法确定
(3)若水中含有Na2SiO3,则在U形管左端会观察到_______ ____。
(4)右端玻璃管的作用是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化锰可用作干电池去极剂,合成工业的催化剂和氧化剂,玻璃工业和搪瓷工业的着色剂、消色剂、脱铁剂等。
Ⅰ(1)锌—锰碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。电池的总反应式为Zn(s)+2MnO2(s)+H2O(l)===Zn(OH)2(s)+Mn2O3(s)。
电池的正极反应式为________________________________
Ⅱ某化学研究性学习小组拟从废旧干电池中回收二氧化锰制取碳酸锰。
①将干电池剖切、分选得到黑色混合物(主要成分为MnO2)洗涤、过滤、烘干。
②将上述固体按固液体积比2:9加入浓盐酸、加热,反应完全后过滤、浓缩。
③向上述溶液中加入Na2CO3溶液,边加边搅拌,再过滤即可得到碳酸锰。
(2)在第②步中,将上述固体与浓盐酸混合的目的是________________________________
(3)有人认为,将第③步中的Na2CO3溶液换成NH4HCO3溶液,也能达到上述目的,但同时有气体生成。请写出加入NH4HCO3溶液时发生的离子反应方程式:
_______________________________________
Ⅲ 湿法炼锰即电解硫酸锰溶液法。电解锰的生产过程分为化合浸取、氧化净化及沉淀除杂、产品回收。其生产工艺流程如下:
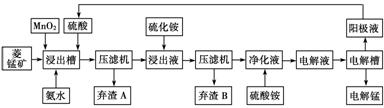
已知:①菱锰矿中主要成份是碳酸锰,主要杂质是Fe2+、Co2+、Ni2+。
②生成氢氧化物的pH如下表:(若某离子浓度小于等于10-5mol/L,则认为完全沉淀)
| 物质 | Fe(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 7.5 | 7.7 | 7.6 | 8.3 |
| 完全沉淀pH | 9.7 | 8.4 | 8.2 | 9.8 |
③有关难溶氢氧化物和硫化物pKsp数据(pKsp=-lgKsp):
| 难溶物质 | Fe(OH)3 | Ni(OH)2 | Co(OH)2 | NiS | CoS |
| pKsp | 38.55 | 15.26 | 14.7 | 18.49 | 20.40 |
(4)菱锰矿粉与硫酸反应的化学方程式是________________________________。
(5)使用氨水的目的是调节pH值在________之间(填pH范围,精确到小数点后1位数字)。
在“浸出液”中加入(NH4)2S(硫化铵)的目的是_________________________________
(6)电解槽中使用的是惰性电极板,电解反应方程式为_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
写出下列化学反应方程式,并标出前三个有机反应类型:
(1)乙烯制乙醇(与水反应):________________________反应类型:( )
(2)丙烯制聚丙烯:_________________________________反应类型:( )
(3)苯与溴反应(液溴):____________________________反应类型:( )
(4)乙炔与HCl反应制氯乙烯: ______________________
(5)制取TNT:_____________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com