
【题目】Ⅰ 某课外活动小组进行Fe(OH)3胶体的制备实验并检验其性质.
(1)现有甲、乙、丙三名同学进行Fe(OH)3胶体的制备。
①甲同学的操作是:取一小烧杯,加入25mL蒸馏水加热至沸腾,向沸水中逐滴加入1~2mL FeCl3饱和溶液,继续煮沸至混合液呈红褐色,停止加热。
②乙向饱和FeCl3溶液直接加入过量的NaOH溶液。
③丙向沸水中滴加饱和FeCl3溶液,为了使反应进行充分,煮沸10分钟。
你认为哪位同学的制备方法正确:_______,发生的化学方程式是______________。
(2)Fe(OH)3胶体稳定存在的主要原因是_____。
A.胶粒小,不受重力作用 B.胶粒带同种电荷
C.胶体具有丁达尔效应 D.胶粒能透过滤纸
(3)Fe(OH)3胶体区别于FeCl3溶液最本质的特征是________________________。
A.Fe(OH)3胶体粒子的直径在1~100nm之间
B.Fe(OH)3胶体具有丁达尔效应
C.Fe(OH)3胶体是均一的分散系
D.Fe(OH)3胶体的分散质能透过滤纸
Ⅱ 根据如图所示实验装置,回答下列问题:

(1)写出下列仪器的名称:②_________,⑦__________。
(2)上述仪器中实验之前需检查装置是否会漏水的有_________________(填仪器名称)。
(3)利用装置甲制备蒸馏水时,冷凝水应从___________(填“f”或“g”)口进入。
(4)利用装置乙用CCl4从碘水中萃取碘,振荡静置后看到的现象是:________________。
(5)利用装置丁进行实验时,玻璃棒的作用是:________________________。
【答案】甲 FeCl3+ 3H2O![]() Fe(OH)3(胶体)+ 3HCl B A 冷凝管 蒸发皿 分液漏斗、容量瓶 g 上层液体无色,下层液体紫红色 受热均匀,防止液体飞溅
Fe(OH)3(胶体)+ 3HCl B A 冷凝管 蒸发皿 分液漏斗、容量瓶 g 上层液体无色,下层液体紫红色 受热均匀,防止液体飞溅
【解析】
Ⅰ.根据胶体制备及其性质解答;
Ⅱ.根据分离提纯的操作注意事项解答。
Ⅰ(1)①实验室制备氢氧化铁胶体是在沸腾的蒸馏水中加入饱和氯化铁溶液,当溶液变为红褐色时立即停止加热,当溶液变为红褐色时应立即停止加热,如继续加热会导致胶体聚沉,故甲正确;
②乙直接加热饱和FeCl3溶液会促进氯化铁水解,且加热促进HCl挥发,导致溶液产生沉淀现象,故乙错误;
③继续煮沸10分钟会产生沉淀,故丙错误;故答案为:甲同学;FeCl3+ 3H2O![]() Fe(OH)3(胶体)+ 3HCl;
Fe(OH)3(胶体)+ 3HCl;
(2)胶体具有很强的吸附能力,能吸附溶液中的离子而带电荷,胶粒之间相互排斥,而不易产生较大微粒而聚沉,故答案为:B;
(3)Fe(OH)3胶体区别于FeCl3溶液最本质的特征是Fe(OH)3胶体的分散质微粒直径大小在1 ~ 100nm之间,故答案为:A;
Ⅱ(1)依据仪器的形状可知:②冷凝管;⑦蒸发皿,故答案为:冷凝管;蒸发皿;
(2)容量瓶带有瓶塞、分液漏斗带有活塞使用前应检查是否漏水,故答案为:分液漏斗、容量瓶;
(3)蒸馏时,冷凝水从冷凝管下口进入,故答案为:g;
(4)CCl4的密度比水大,且不与水互溶,所以在溶液下方,碘单质易溶于CCl4,碘的有机溶剂的颜色为紫色,故答案为:上层液体无色,下层液体紫红色;
(5)顶装置的操作是蒸发,玻璃棒的作用是:受热均匀,防止液体飞溅,故答案为:受热均匀,防止液体飞溅。


科目:高中化学 来源: 题型:
【题目】某同学进行如下实验,研究化学反应中的热量变化。

请回答下列问题:
(1)反应后①中温度升高,②中温度降低。由此判断铝条与盐酸的反应是________反应(填“放热”或“吸热”,下同),Ba(OH)2·8H2O与NH4Cl的反应是________反应。
(2)1.00L 1.00mol/L H2SO4溶液与2.00L 1.00mol/L NaOH溶液完全反应,放出114.6kJ的热量,该反应的中和热为______,表示其中和热的热化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种元素的原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的4倍。请回答下列问题:
(1)F的基态原子价电子排布式为____________________ 。
(2)B、C、D、E的原子的第一电离能由小到大的顺序为_______________(用元素符号回答)
(3)下列关于B2A2分子和A2D2分子的说法正确的是______________
A 分子中都含有σ键和π键
B 中心原子都sp杂化
C 都是含极性键和非极性键的非极性分子
D 互为等电子体
E.B2A2分子的沸点明显低于A2D2分子
(4)F2+能与BD分子形成[F(BD)4]2+,其原因是BD分子中含有_________
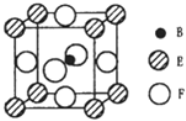
(5)由B、E、F三种元素形成的一种具有超导性的晶体,晶胞如图所示.B位于E和F原子紧密堆积所形成的空隙当中.与一个F原子距离最近的F原子的数目为_________,该晶体的化学式为_______.若该晶体的相对分子质量为M,阿伏加德罗常数为NA,B、E、F三种元素的原子半径分别为r1pm、r2pm、r3pm,则该晶体的密度表达式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据VSEPR模型判断,下列微粒中所有原子都在同一平面上的是( )
A. SO32- 和NO2-B. NO3- 和SO32-C. ![]() 和ClO3-D. PO43- 和SO32-
和ClO3-D. PO43- 和SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年秋天,毒奶粉事件震惊全国,这主要是奶粉中含有有毒的三聚氰胺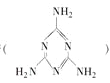 。下列关于三聚氰胺分子的说法正确的是
。下列关于三聚氰胺分子的说法正确的是
A. 所有碳原子采用sp3杂化,所有氮原子采用sp3杂化
B. 一个分子中共含有15个σ键
C. 属于极性分子,故极易溶于水
D. 分子内既有极性键又有非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:

(1)请写出A装置中发生反应的化学方程式_____。
(2)饱和食盐水的作用是_____。
(3)装置B中盛放的试剂是_____(选填下列所给试剂的代码),反应离子方程式是_____。
A.N![]() S溶液 B.N
S溶液 B.N![]() S
S![]() 溶液 C.N
溶液 C.N![]() S
S![]() 溶液
溶液
(4)还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强_____(填编号)
①HCl比![]() S稳定 ②HClO氧化性比
S稳定 ②HClO氧化性比![]() S
S![]() 强 ③HCl
强 ③HCl![]() 酸性比
酸性比![]() S
S![]() 强 ④HCl酸性比
强 ④HCl酸性比![]() S强 ⑤氯原子最外层有7个电子,硫原子最外层有6个电子 ⑥铁与C
S强 ⑤氯原子最外层有7个电子,硫原子最外层有6个电子 ⑥铁与C![]() 反应生成FeC
反应生成FeC![]() ,而硫与铁反应生成FeS
,而硫与铁反应生成FeS
(5)此装置有多种用途,若用此装置验证氯元素的非金属性比碘元素的强,需要在B装置中加入KI溶液,通入一段时间气体后向B中加入少量CC![]() ,振荡。能够证明氯元素的非金属性比碘元素的强的实验现象是_____
,振荡。能够证明氯元素的非金属性比碘元素的强的实验现象是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是高中化学常用的物理量,请完成以下有关计算。
(1)含500mL 0.8 mol/L 的Al2(SO4)3中所含的SO![]() 的物质的量是___________。
的物质的量是___________。
(2)标准状况下,___________ L NH3所含氢原子数与0.2molH3PO4所含氢原子数相等。
(3)将20ml物质的量浓度为6mol/L的MgSO4加水稀释成100ml溶液,所得稀硫酸的物质的量浓度是_____________。
(4)a个X原子的总质量为bg,则X的相对原子质量可以表示为_______________。
(5)同温同压下,同体积的甲烷(CH4)和二氧化碳分子数之比为__________,质量之比为__________。
(6)等质量的 SO2 和 SO3 物质的量之比是____________,氧原子数之比为____________。
(7)25.4 g某二价金属A的氯化物中含有0.4mol Cl-,则A的摩尔质量为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对矿井下空气进行氧气含量测定既能保证矿工的身体健康又能为瓦斯灾害处理提供数据。缺氧场所常采用伽伐尼电池型氧传感器检测氧气浓度,该传感器结构如图所示,工作电极为Pb,对比电极为Pt,电池液为KOH溶液。下列说法不正确的是

A.氧在对比电极被还原
B.工作电极的电极反应为Pb+2OH--2e-=Pb(OH)2
C.外电路电子由对比电极流向工作电极
D.该传感器测定氧气浓度时不需外加电源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从制溴苯的实验中分离出FeBr3溶液,得到溴的苯溶液和无水FeCl3。下列设计能达到相应实验目的的是

A.用装置甲制取氯气按图示通入装置乙中能使Br-全部转化为溴单质
B.用装置丙分液时先从下口放出水层,换一容器从上口倒出有机层
C.检验溶液中是否氧化完全,取水层少许滴加硝酸银溶液,看有无沉淀生成
D.用装置丁将分液后的水层溶液蒸发至有大量晶体析出时,停止加热,余热蒸干
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com