
 (1)某温度下,在一密闭容器中,X、Y、Z 三种气体的物质的量随时间的变化曲线如图所示.分析有关数据,写出X、Y、Z反应的化学方程式X+3Y
(1)某温度下,在一密闭容器中,X、Y、Z 三种气体的物质的量随时间的变化曲线如图所示.分析有关数据,写出X、Y、Z反应的化学方程式X+3Y 2Z.
2Z.分析 (1)由图象可知,反应中X、Y的物质的量减少,应为反应物,Z的物质的量增多,应为生成物,当反应进行到2min时,X、Y的物质的量不变且不为0,属于可逆反应,△n(Y)=0.3mol,△n(X)=0.1mol,△n(Z)=0.2mol,参加反应的物质的物质的量之比等于化学计量数之比;
(2)可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、物质的量、含量保持不变,右侧衍生的其它一些物理量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化,说明到达平衡;
(3)设消耗的X为nmol,表示出平衡时各组分物质的量,再根据Z的含量列方程计算解答.
解答 解(1)由图象可知,反应中X、Y的物质的量减少,应为反应物,Z的物质的量增多,应为生成物,当反应进行到2min时,X、Y的物质的量不变且不为0,属于可逆反应,△n(Y)=0.3mol,△n(X)=0.1mol,△n(Z)=0.2mol,则△n(Y):△n(X):△n(Z)=3:1:2,参加反应的物质的物质的量之比等于化学计量数之比,则反应的方程式为:X+3Y 2Z,
2Z,
故答案为:X+3Y 2Z;
2Z;
(2)A.X、Y的起始物质的量相等,二者按1:3反应,平衡时二者物质的量浓度一定不相等,故A错误;
B.温度和体积一定时,生成物浓度不再变化,说明到达平衡,故B正确;
C.随反应进行混合气体总物质的量减小,温度和体积一定时,随反应进行压强减小,若容器内的压强不再变化,说明到达平衡,故C正确;
D.混合气体总质量不变,随反应进行混合气体总物质的量减小,混合气体的平均相对分子质量增大,若混合气体的平均相对分子质量不再变化,说明到达平衡,故D正确,
故选:BCD;
(3)设消耗的X为nmol,则:
X(g)+3Y(g) 2Z(g)
2Z(g)
起始量(mol):2 3 0
变化量(mol):n 3n 2n
平衡量(mol):2-n 3-3n 2n
所以$\frac{2n}{5-2n}$=25%,解得n=0.5,则平衡时X的物质的量浓度为$\frac{(2-0.5)mol}{2L}$=0.75mol/L,
故答案为:0.75mol/L.
点评 本题考查化学平衡计算、平衡状态判断等,难度不大,注意判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
 “诺龙”属于国际奥委会明确规定的违禁药品中合成代谢类的类固醇,其结构简式如图所示.下列关于“诺龙”的说法中错误的是( )
“诺龙”属于国际奥委会明确规定的违禁药品中合成代谢类的类固醇,其结构简式如图所示.下列关于“诺龙”的说法中错误的是( )| A. | 分子式是C18H26O2 | |
| B. | 能发生银镜反应 | |
| C. | 既能发生加成反应,也能发生酯化反应 | |
| D. | 既能发生氧化反应,也能发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜和稀硫酸反应:Cu+2H+═Cu2++H2↑ | |
| B. | 氢氧化铜溶于盐酸:Cu(OH)2+2H+═Cu2++2H2O | |
| C. | 碳酸钙与稀盐酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | 硫酸与氢氧化钡溶液反应:H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
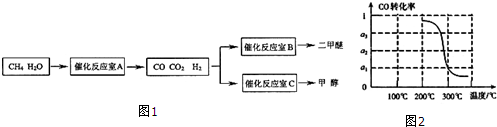
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:填空题
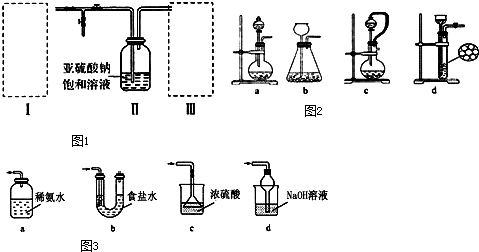
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
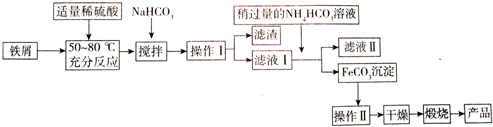
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 沉淀完全 | 3.2 | 9.7 | 4.4 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若某温度下,反应后$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$=2,则溶液中$\frac{c(Cl{O}^{-})}{c(Cl{O}_{3}^{-})}$=0.2 | |
| B. | 参加反应的氯气的物质的量等于0.5a mol | |
| C. | 改变温度,反应中转移电子的物质的量ne的范围:$\frac{1}{2}$a mol≤ne≤$\frac{5}{6}$a mol | |
| D. | 改变温度,产物中KClO3的最大理论产量为$\frac{a}{6}$mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com