
经测定某种溶液中只含 四种离子,下列说法错误的是( )
四种离子,下列说法错误的是( )
A.若满足: ,则溶质一定是
,则溶质一定是
B.若满足: ,则溶质一定是
,则溶质一定是 和
和
C.溶液中四种离子之间可能满足:
D.若满足: ,则溶液一定呈中性
,则溶液一定呈中性
科目:高中化学 来源: 题型:
A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平,D是具有果香气味的烃的衍生物。A、B、C、D在一定条件下存在如下转化关系(部分反应条件、产物被省略)。

⑴工业上,由石油获得石蜡油的方法是_____ __ _,由石蜡油获得A是___ __变化(“物理”或“化学”)。
⑵写出反应B+C→ D的化学方程式: _____________________________ __。
⑶丁烷是由石蜡油获得A的过程中的中间产物之一,写出它的两种同分异构体的结构简式:
。
查看答案和解析>>
科目:高中化学 来源: 题型:
除去下列物质中所含杂质(括号中的物质)所选用的试剂和装置均正确的是 ( )
Ⅰ.试剂:①KMnO4/H+②NaOH溶液 ③饱和Na2CO3溶液④H2O ⑤Na
⑥Br2/H2O ⑦Br2/CCl4
Ⅱ.装置:

| 选项 | 物质 | 试剂 | 装置 |
| A | C2H6(C2H4) | ⑥ | ① |
| B | 苯(苯酚) | ① | ③ |
| C | CH3COOC2H5(CH3COOH) | ③ | ② |
| D | 甲苯(二甲苯) | ① | ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:
CH3CH2OH-4e—+H2O==CH3COOH+4H+。下列有关说法正确的是
A.检测时,电解质溶液中的H+向负极移动
B.若有 0.4 mol电子转移,则在标准状况下消耗 4.48 L氧气
C.电池反应的化学方程式为:CH3CH2OH+O2===CH3COOH+H2O
D.正极上发生的反应为:O2+4e-+2H2O===4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
无水AlCl3可用作有机合成的催化剂、食品膨松剂等。工业上由铝土矿(主要成分是A12O3和Fe2O3)和石油焦(主要成分是C)按下图所示流程进行一系列反应来制备无水AlCl3。
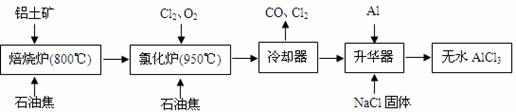
(1)氯化铝在加热条件下易升华,气态氯化铝的化学式为Al2Cl6,每种元素的原子最外层均达到8电子稳定结构,则AlCl3是 晶体,其结构式为 。
(2)氯化炉中Al2O3、Cl2和C反应的化学方程式是 。
(3)冷却器排出的尾气中含有大量CO和少量Cl2,需用Na2SO3溶液除去Cl2,此反应的离子方程式为: 。
(4)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是: 。
(5)AlCl3产品中Fe元素含量直接影响其品质,为测定产品中Fe元素的含量,现称取16.25g无水AlCl3产品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重残留固体质量为0.32g。则产品中Fe元素的含量为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
由化合物A、M开始,可发生如图所示的变化。已知A由两种元素组成,且两元素的质量比为1:3 ,B、P、Y都是由短周期元素形成的简单氢化物,常温下Y为无色液体,B、P均为可燃性气体,M也是由两种短周期元素组成化合物,且M的焰色反应为黄色,C是一种不溶于水的白色固体,Q属于酸性氧化物。(框图中生成的水均已略去)

(1)A化学式为 。
(2)在25℃,101 kPa的条件下,若10g B在氧气中完全燃烧生成稳定氧化物所放出的热量为556.44 kJ,请写出表示C燃烧热的热化学方程式_____________________________。
(3)反应①的化学方程式为:_______________________________________________
(4)在反应①②③④⑤中属于氧化还原反应的是 。(填反应序号)
(5)对0.1mol/L 的F溶液进行检测,其溶液应呈 性(填“酸”或“碱”),用离子方程式解释溶液呈现此性质的原因 ,该溶液中各离子的浓度由大到小关系为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
发射卫星的火箭推进器中大多使用燃料偏二甲肼,其化学式C2H8N2。计算:
(1)偏二甲肼的摩尔质量是________;480 g偏二甲肼的物质的量为________。
(2)偏二甲肼中碳原子与氮原子的个数之比是________,其物质的量之比是________;1mol偏二甲肼中含有的氢原子数目是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
[化学——选修3;物质结构与性质](15分)
周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。回答下列问题;
(1)b、c、d中第一电离能最大的是________(填元素符号),e的价层电子轨道示意图为________。
(2)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为______;分子中既含有极性共价键、又含有非极性共价键的化合物是________(填化学式,写出两种)。
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是________;酸根呈三角锥结构的酸是________。(填化学式)
(4)e和c形成的一种离子化合物的晶体结构如图(a),则e离子的电荷为________。
(5)这5种元素形成的一种1∶1型离子化合物中,阴离子呈四面体结构;阳离子呈轴向狭长的八面体结构[如图(b)所示]。


(a) (b)
该化合物中,阴离子为________,阳离子中存在的化学键类型有________;该化合物加热时首先失去的组分是________,判断理由是______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com