
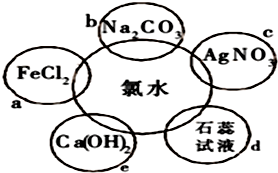
分析 I.氯气与碘化钾反应生成碘,淀粉遇碘变蓝色;
II.(1)氯气和氢氧化钠反应生成氯化钠和次氯酸钠;
(2)①根据m=nM=cVM计算;
②配制250mL 4.0mol•L-1NaOH溶液,应按照计算、称量、溶解、移液、洗涤、定容、摇匀的步骤;
③根据操作的步骤确定所需仪器.
解答 解:I.氯气与碘化钾反应生成碘,淀粉遇碘变蓝色,反应的方程式为Cl2+2KI=I2+2KCl,氯气的氧化性大于碘单质,故答案为:溶液由无色变为蓝色;>;
II.(1)氯气和氢氧化钠反应生成氯化钠和次氯酸钠,反应的离子方程式为Cl2+2OH-=ClO-+Cl?+H2O,故答案为:Cl2+2OH-=ClO-+Cl?+H2O;
(2)①n(NaOH)=0.25L×4mol/L=1mol,m(NaOH)=1mol×40g/mol=40.0g,
故答案为:40.0g;
②操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解.冷却后转移到2500mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀;
则正确的顺序为a b d c f e,
故答案为:a b d c f e;
③配制顺序是:计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶贴签,一般用天平称量(用到药匙)称量,在烧杯中溶解,冷却后转移到250mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀.所以需要的仪器有托盘天平、药匙、烧杯、玻璃棒、250mL容量瓶、胶头滴管,则还需要胶头滴管、250 mL容量瓶,
故答案为:胶头滴管;250 mL容量瓶.
点评 本题考查较为综合,涉及氯气的性质、溶液的配制,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质以及实验方法,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热△H=-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |
| B. | 一定条件下,将0.5 mol N2和1.5 molH2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ/mol | |
| C. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | |
| D. | HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
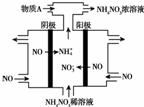 NH4NO3主要用作肥料、军用炸药、冷冻剂、制造笑气等.
NH4NO3主要用作肥料、军用炸药、冷冻剂、制造笑气等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铅笔芯的原材料为铅,儿童使用铅笔时如果用嘴吮吸能够引起铅中毒 | |
| B. | “轻轨电车”是一种交通工具,当电车启动时,电车电刷与导线的接触点上由于摩擦会产生高温,因此接触点上的材料应该选用耐高温、能导电的物质,石墨恰好合适 | |
| C. | 为防止中秋月饼等富含脂质食品氧化变质,常在包装袋中放入生石灰 | |
| D. | 双氧水是绿色氧化剂,可作医疗消毒剂,说明H2O2对人体无害 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体硅制作的光导纤维遇强碱会“断路” | |
| B. | 煤的综合利用主要是通过煤的干馏、液化和气化以获得洁净的燃料和多种化工原料 | |
| C. | 氢气燃烧能放出大量的热量,燃烧产物是水,所以是理想的清洁燃料 | |
| D. | 化学电源有一次电池和二次电池之分,一次电池用过之后不能复原 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com