
镁在工业、医疗等领域均有重要用途。某化学小组利用硼砂工厂的固体废弃物(主要含有MgCO3、MgSiO3、Al2O3和Fe2O3等),设计了回收其中镁的工艺流程:
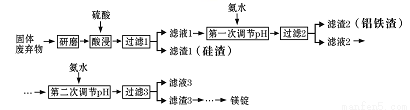
(1)酸浸前,将固体废弃物研磨的目的是_______,为达到此目的,还可以采取的措施是_____(任写一条)。
(2)酸浸时,生成滤渣I的离子方程式为_________。
(3)第一次调节pH的目的是_____。当加入氨水使Al3+开始沉淀时,溶液中c(Fe3+)/c(Al3+)为 _________ 。已知Ksp[Fe(OH)3 ]=4×10-38,Ksp[Al(OH)3 ]=1×10-33.
(4)设计简单方案分离滤渣2,简述实验过程:______。
(5)滤液3中可回收利用的物质主要是_____(填化学式),其阳离子的电子式为 _______。
(6)写出工业上从滤渣3中获得镁锭的所有反应的化学方程式:_______。
科目:高中化学 来源:2017届江苏省南京市、盐城市高三第二次模拟考试化学试卷(解析版) 题型:选择题
吗替麦考酚酯主要用于预防同种异体的器官排斥反应,其结构简式如下图所示。
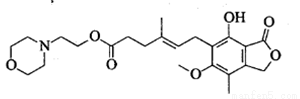
下列说法正确的是
A. 吗替麦考酚酯的分子式为C23H30O7N
B. 吗替麦考酚酯可发生加成、取代、消去反应
C. 吗替麦考酚酯分子中所有碳原子一定处于同一平面
D. 1mol吗替麦考酚酯与NaOH溶液充分反应最多消耗3mol NaOH反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省西安市高二下学期第一次教学检测化学试卷(解析版) 题型:选择题
下列物质中,既能发生水解反应,又能发生加成反应,但不能发生消去反应的是( )
A. CH2=CH—CH2CH2Cl B. CH3CH2Cl
C. CH3Br D. 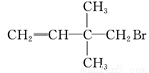
查看答案和解析>>
科目:高中化学 来源:2017届北京市海淀区高三3月适应性考试(零模)理综化学试卷(解析版) 题型:简答题
海水中含有80多种元素,是重要的物质资源宝库,同时海水具有强大的自然调节能力,为解决环境污染问题提供了广阔的空间。
(1)①已知不同pH条件下,水溶液中碳元素的存在形态如下图所示。下列说法不正确的是______________(填字母序号)。

a.pH=8时,溶液中含碳元素的微粒主要是HCO3-
b.A点,溶液中H2CO3和HCO3-浓度相同
c.当c(HCO3-)=c(CO32-)时,c(H+)>c(OH -)
②向上述pH=8.4的水溶液中加入NaOH溶液时发生反应的离子方程式是______________。
(2)海水pH稳定在7.9—8.4之间,可用于烟道气中CO2和SO2的吸收剂。
①海水中含有的OH -可以吸收烟道气中的CO2同时为海水脱钙,生产CaCO3。写出此反应的离子方程式:__________。
②已知:25℃时,H2CO3电离平衡常数K1=4.3×10-7 K2=5.6×10 -11
H2SO3电离平衡常数K1=1.5×10-2 K2 =6.0×10-8
海水中含有的HCO3-可用于吸收SO2,该过程的离子方程式是_______________。
(3)洗涤烟气后的海水呈酸性,需处理后再行排放。与新鲜海水混合同时鼓入大量空气排出部分CO2,是一种处理的有效方式。
①通入O2可将酸性海水中的硫(IV)氧化,该反应的离子方程式是_______________。
②上述方式使处理后海水pH升高的原因是_________________。
查看答案和解析>>
科目:高中化学 来源:2017届北京市海淀区高三3月适应性考试(零模)理综化学试卷(解析版) 题型:选择题
a、b、c、d为原子序数依次增大的四种短周期主族元素。a的最外层电子数是内层电子数的3倍,b的M层上有1个电子,a与c同主族。下列说法不正确的是
A. 原子半径:b>c>d
B. 气态氢化物稳定性:a>c
C. 简单阴离子还原性:d>c
D. ab可形成既含离子键又含共价键的离子化合物
查看答案和解析>>
科目:高中化学 来源:2017届湖北省新联考高三第四次联考理科综合化学试卷(解析版) 题型:选择题
下列实验设计能够达到目的的是
A | B | C | D |
制取无水MgCl2 | 比较非金属性:C>Si | 用如图装置收集NH3 | 实验室模拟石油分馏 |
|
|
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:辽宁省葫芦岛市高三第一次模拟考试理综化学试卷 题型:填空题
二氧化铈(CeO2)是一种重要的稀土氧化物,平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。
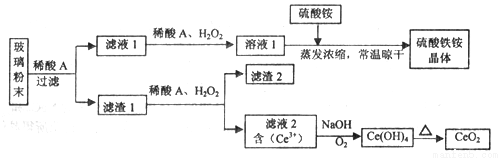
已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液。
(1)稀酸A的分子式是_____________________。
(2)滤液1中加入H2O2溶液的目的是__________________。
(3)设计实验证明滤液1中含有Fe2+_____________________。
(4)已知Fe2+溶液可以和难溶于水的FeO(OH)反应生成Fe3O4,书写该反应的离子方程式____________。
(5)由滤液2生成Ce(OH)4的离子方程式__________________。
(6)硫酸铁铵晶体[Fe2(SO4)3·2(NH4)2SO4·3H2O]广泛用于水的净化处理,但其在去除酸性废水中的悬浮物时效率降低,其原因是___________________。
(7)取上述流程中得到的Ce(OH)4产品0.531 g,加硫酸溶解后,用浓度为0.l000mol·L-1FeSO 4标准溶液滴定至终点时(铈被还原为Ce3+ ),消耗25.00 mL标准溶液。该产品中Ce(OH)4的质置分数为_______(结果保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏省高二下学期第一次月考化学试卷(解析版) 题型:选择题
下列关于能层与能级的说法中正确的是
A. 任一能层的能级总是从s能级开始,且能级数不等于该能层序数
B. 同是s能级,在不同的能层中所能容纳的最多电子数是不相同的
C. 1个原子轨道里最多只能容纳2个电子,但自旋方向相同
D. 原子核外电子的每一个能层最多可容纳的电子数为2n2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高一3月月考化学试卷(解析版) 题型:选择题
X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且 X、Y、Z相邻。X的核电荷数为Y的核外电子数的一半,Y与M可形成化合物M2Y。下列说法正确的是
A. 稳定性:X的氢化物>Y的氢化物>Z的氢化物
B. 简单离子的半径:M的离子>Z的离子>Y的离子>X的离子
C. YX2、M2Y都是含有极性键的极性分子
D. Z元素的最高价氧化物的水化物的化学式为HZO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com