
| A. | CH4 ( g )+$\frac{3}{2}$O2( g )═2H2O ( l )+CO ( g )△H1 | |
| B. | S ( s )+$\frac{3}{2}$O2 ( g )═SO3 ( s )△H2 | |
| C. | C6H12O6 ( s )+6O2 ( g )═6CO2 (g)+6H2O ( l )△H3 | |
| D. | 2CO ( g )+O2( g )═2CO2 ( g )△H4 |
 提分百分百检测卷系列答案
提分百分百检测卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式:CH2CH2 | B. | 乙酸的结构式:CH3COOH | ||
| C. | 2-丁烯的键线式: | D. | 乙醇分子的比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
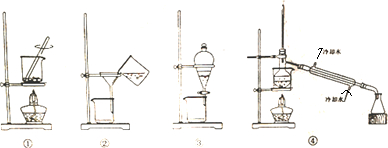
| A. | 装置①将海带灼烧成灰 | B. | 装置②过滤含I-的溶液 | ||
| C. | 装置③放出碘的CCl4溶液 | D. | 装置④分离碘并回收CCl4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.00molNaCl中含有6.02×1023个NaCl分子 | |
| B. | 1.00molNaCl中,所有的Na+的最外层电子总数8×6.02×1023 | |
| C. | 欲配制1L1.00mol/L的NaCl溶液,可将58.5gNaCl溶于1.00L水中 | |
| D. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | H3PO2的电离方程式为:H3PO2?H2PO2-+H+;电离常数Ka≈10-5 | |
| B. | B点溶液中存在关系:2c(H+)+c(H3PO2)=2c(OH-)+c(H2PO2-) | |
| C. | 图2中的a点对应为 图1中的B点 | |
| D. | D点时,溶液中微粒浓度大小关系为:c(Na+)>c(H2PO2-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:
图为实验室某浓硫酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和甲苯都能使酸性高锰酸钾溶液褪色 | |
| B. | 凡是能起银镜反应的物质一定是醛 | |
| C. | 在酯化反应中,羧酸脱去羧基中的氢原子,醇脱去羟基生成水和酯 | |
| D. | 苯酚有弱酸性,因此它是一种羧酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com