
| A. |  | B. |  | C. |  | D. |  |
科目:高中化学 来源: 题型:选择题
| A. | 一定是金属元素 | |
| B. | 一定能和氢氧化钠溶液反应生成氢气 | |
| C. | 一定是ⅡA族元素 | |
| D. | 可能是金属元素,也可能不是金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
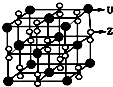 X、Y、Z、W、U为原子序数依次增大的前四周期元素,X、Y、Z三种元素位于第二周期且相邻,W是非金属元素,其中基态Y原子的2p轨道处于半充满状态,基态W原子的3p能级上有一个未成对电子.含U的化合物的焰色为紫色.试回答下列问题:
X、Y、Z、W、U为原子序数依次增大的前四周期元素,X、Y、Z三种元素位于第二周期且相邻,W是非金属元素,其中基态Y原子的2p轨道处于半充满状态,基态W原子的3p能级上有一个未成对电子.含U的化合物的焰色为紫色.试回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=2mol/(L•min) v(B)=2mol/(L•min) | |
| B. | v(A)=2mol/(L•min) v(C)=2mol/(L•min) | |
| C. | v(A)=1mol/(L•min) v(B)=2mol/(L•min) | |
| D. | v(A)=1mol/(L•min) v(C)=1.5mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 盐泥是氯碱工业中的废渣,主要成分是镁的硅酸盐和碳酸盐(含少量铁、铝、钙的盐).实验室以盐泥为原料制取MgSO4•7H2O的实验过程如下:
盐泥是氯碱工业中的废渣,主要成分是镁的硅酸盐和碳酸盐(含少量铁、铝、钙的盐).实验室以盐泥为原料制取MgSO4•7H2O的实验过程如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用Na、Mg分别与冷水反应来证明Na、Mg的金属性强弱 | |
| B. | 用同物质的量浓度的H2SO3酸性比H2CO3强,证明S的非金属性比C强 | |
| C. | 用HCl和HBr形成的难易程度,证明Cl的非金属性比Br强 | |
| D. | 用Cu、Mg分别与盐酸反应来证明Cu、Mg的金属性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
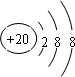 .
. ,C的最高价氧化物的水化物化学式为:Al(OH)3.
,C的最高价氧化物的水化物化学式为:Al(OH)3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锂是较轻的金属 | B. | LiOH的碱性比NaOH弱 | ||
| C. | 锂的化学性质比钠活泼 | D. | 锂在空气中燃烧生成Li2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
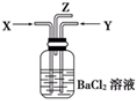 盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.现就硫酸、硝酸与金属铜反应的情况,回答下列问题:
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.现就硫酸、硝酸与金属铜反应的情况,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com