
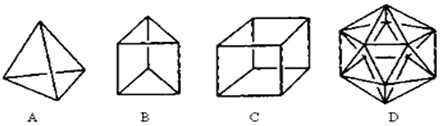
 .
. 分析 (1)图中D每个C原子形成5个共价键;
(2)根据结构可知最多可插入6个CH2原子团,根据C、H原子数判断分子式;
(3)在结构A中含有4H和4个C;
(4)B的一种同分异构体是最简单的芳香烃应为苯,根据苯的结构判断;
(5)丙分子的一氯代物只有一种,其分子中含有3种氢原子,所以丙分子的二氯取代产物只有三种,然后判断六氯代物;
(6)C的一种属于芳香烃的同分异构体是生产某塑料的单体,应为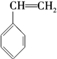 .
.
解答 解:(1)图中D每个C原子形成5个共价键,而碳原子最多只能形成4个共价键,结构D显然是不可能合成的,
故答案为:碳原子最多只能形成4个共价键;
(2)根据结构可知最多可插入6个CH2原子团,则C应为10个,H应为6×2+4=16,所以分子式为C10H16,
故答案为:C10H16;
(3)在结构A中含有4H和4个C,A的一种链状烃类同分异构体可由两分子乙炔聚合得到,则该链状烃的结构简式为CH2=CH-C≡CH;
故答案为:CH2=CH-C≡CH;
(4)最简单的芳香烃应为苯,化学键不是单双键交替,分子中所有碳碳键的键长均相等,它的邻位二元取代物只有一种,可证明该结构特征,而无论是否单双键交替,它的对位二元取代物都只有一种,且在一定条件下都能发生取代反应和加成反应,所以证明的为bc,
故答案为:bc;
(5)丙分子的一氯代物只有一种,一氯代物分子中含有3种氢原子,分别在同一条边上、面对角线上和体对角线上,所以丙分子的二氯取代产物只有三种,该分子的分子式为C8H8,所以六氯代物的同分异构体有3种;
故答案为:3;
(6)C的一种属于芳香烃的同分异构体是生产某塑料的单体,应为苯乙烯,其加聚合成该塑料的化学方程式是 ,
,
故答案为: .
.
点评 本题考查有机物的结构和性质,题目难度中等,本题注意把握有机物的空间结构和碳原子的成键特点,侧重于考查学生的分析能力和对基础知识的综合应用能力.


科目:高中化学 来源: 题型:选择题
 如图为某化学反应的速率与时间的关系示意图.在t1时刻升高温度或者增大压强,速率的变化都符合的示意图的反应是( )
如图为某化学反应的速率与时间的关系示意图.在t1时刻升高温度或者增大压强,速率的变化都符合的示意图的反应是( )| A. | 2SO2(g)+O2(g)?2SO3(g) H<0 | B. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g) H<0 m | ||
| C. | H2(g)+I2(g)?2HI(g) H>0 | D. | N2(g)+3H2(g)?2 NH3(g) H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
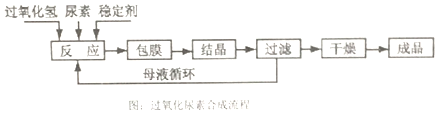
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
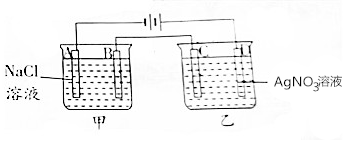 按如图进行电解实验(A,B,C,D均为惰性电极).
按如图进行电解实验(A,B,C,D均为惰性电极).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有电子转移是氧化还原反应的本质,有元素化合价的变化是氧化还原反应的外在表现 | |
| B. | 一种物质被氧化,必然有另一种物质被还原 | |
| C. | 被氧化的物质得到或偏向电子,被还原的物质失去或偏离电子 | |
| D. | 氧化反应就是得到或偏向电子的反应,还原反应就是失去或偏离电子的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某溶液加入足量硝酸银溶液产生白色沉淀,证明其中一定存在Cl- | |
| B. | 某溶液加入足量稀盐酸无现象,再加入BaCl2产生白色沉淀,证明其中一定存在SO42- | |
| C. | 某溶液加人稀盐酸产生无色、无味能使澄请石灰水变混浊的气体,证明其中一定存在CO32- | |
| D. | 向品红溶液中通入某气体后,品红溶液红色消失,证明该气体一定是SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠失火时立即用水灭火,然后用稀硫酸中和 | |
| B. | 为了防止挥发,氢氧化钠溶液保存在用磨砂玻璃塞的玻璃试剂瓶中 | |
| C. | 少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 | |
| D. | 配置一定物质的量浓度溶液时,不慎将少量水加过刻度线,应重新配置 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
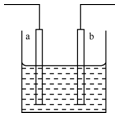
| A. | a,b可能是同种材料的电极 | |
| B. | 该装置可能是电解池,电解质溶液为稀硝酸 | |
| C. | 该装置可能是原电池,电解质溶液为稀盐酸 | |
| D. | 该装置可看作是铜一锌原电池,电解质溶液是稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
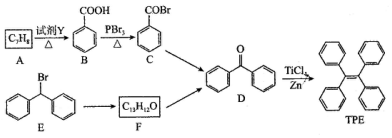
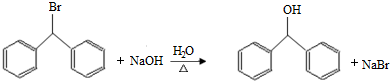 .
. )的一元取代物;②存在羟甲基(-CH2OH).写出W所有可能的结构简式
)的一元取代物;②存在羟甲基(-CH2OH).写出W所有可能的结构简式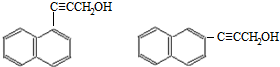 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com