
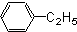 芳香烃,(7)
芳香烃,(7)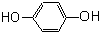 酚,(8)
酚,(8)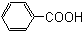 芳香酸.
芳香酸. 分析 根据烃的衍生物的官能团可确定有机物的种类,常见有机物有烯烃、炔烃、醇、酚、醛、酸、酯等,结合有机物的结构简式判断有机物的种类.
解答 解:(1)CH3CH2CH2COOH:官能团为羧基,属于羧酸;
(2)CH3CH2CH2CH2-Cl:官能团为氯原子,故属于卤代烃;
(3)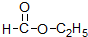 :分子中含有酯基,属于酯;
:分子中含有酯基,属于酯;
(4)CH3CHO:官能团为醛基,故属于醛;
(5)CH3CH2CH=CHCH3:此物质是官能团为碳碳双键的烃类,故属于烯烃;
(6) :该有机物为乙苯,分子中不含官能团,含有苯环,属于芳香烃;
:该有机物为乙苯,分子中不含官能团,含有苯环,属于芳香烃;
(7)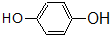 :官能团为羟基,属于酚;
:官能团为羟基,属于酚;
(8)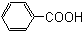 :由于含苯环,且官能团为羧基,属于芳香酸;
:由于含苯环,且官能团为羧基,属于芳香酸;
故答案为:(1)羧酸,(2)卤代烃,(3)酯,(4)醛,(5)烯烃,(6)芳香烃,(7)酚,(8)芳香酸.
点评 本题考查有机物的官能团及其结构,题目难度不大,注意把握有机物的结构特点和官能团的结构和性质,学习中注意把握有机物的类别和性质.


科目:高中化学 来源: 题型:选择题
| A. | 元素原子失电子能力:X>W | B. | 离子的还原性:Z->Y2- | ||
| C. | 氢化物的稳定性:H2Y>HZ | D. | 原子半径:X<W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾溶于水产生Al(OH)3 胶体,离子方程式可表示为:Al3++3H2O═Al(OH)3↓+3H+ | |
| B. | 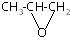 和CO2反应生成可降解聚合物 和CO2反应生成可降解聚合物 ,该反应符合绿色化学的原则 ,该反应符合绿色化学的原则 | |
| C. | 用乙醇和浓H2SO4制备乙烯时,可用水浴加热控制反应的温度 | |
| D. | 聚氯乙烯塑料制品可用于食品的包装 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④⑤ | C. | ①②③⑤ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
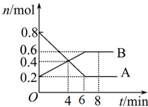 某温度时,在2L密闭容器中某一反应的A、B物质的量随时间变化的曲线如图所示.
某温度时,在2L密闭容器中某一反应的A、B物质的量随时间变化的曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
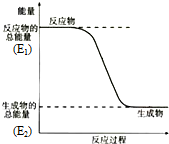 某元素的原子最外层电子数是次外层电子数的两倍,该元素是碳;它在元素周期表中的位置是第二周期第ⅣA族;该元素和氢元素组成的某种有机物是“西气东输”中“气”的主要成分,这种有机物的电子式为
某元素的原子最外层电子数是次外层电子数的两倍,该元素是碳;它在元素周期表中的位置是第二周期第ⅣA族;该元素和氢元素组成的某种有机物是“西气东输”中“气”的主要成分,这种有机物的电子式为 ;结构式
;结构式 ;空间构型:正四面体.这种化合物中碳元素的质量分数为75%.该物质在氧气中充分燃烧的反应方程式:CH4+2O2 $\stackrel{点燃}{→}$CO2+2H2O.一定量的该气体燃烧过程的能量变化如图所示,从图中可以读出E1>E2(填写“>”或者“<”),该反应放热(填写“放出”或者“吸收”)能量.该物质与Cl2反应方程式为:CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl(只写出第一步反应),该反应类型为取代反应.
;空间构型:正四面体.这种化合物中碳元素的质量分数为75%.该物质在氧气中充分燃烧的反应方程式:CH4+2O2 $\stackrel{点燃}{→}$CO2+2H2O.一定量的该气体燃烧过程的能量变化如图所示,从图中可以读出E1>E2(填写“>”或者“<”),该反应放热(填写“放出”或者“吸收”)能量.该物质与Cl2反应方程式为:CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl(只写出第一步反应),该反应类型为取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 含量/% 阶段 | Y2O3 | ZnO | Al2O3 | PbO2 | MgO |
| 预处理前 | 24.28 | 41.82 | 7.81 | 1.67 | 0.19 |
| 预处理后 | 68.51 | 5.42 | 4.33 | 5.43 | 0.50 |
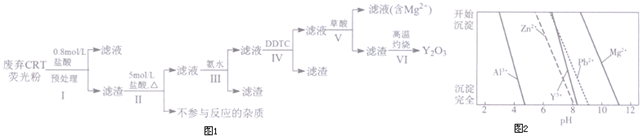
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com