
下列电离方程式正确的是
A.NaHS溶于水:NaHS==Na++HS-;HS-+H2O H3O++S2-
H3O++S2-
B.(NH4)2SO4溶于水:(NH4)2SO4 2NH4++SO42-
2NH4++SO42-
C.磷酸溶于水中:H3PO4==3H++PO43-
D.Al(OH)3的电离:Al(OH)3=Al3++3OH-
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源:2017届北京市昌平区高三上学期期末化学试卷(解析版) 题型:选择题
利用如图所示装置进行下列实验,能得出相应实验结论的是
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓盐酸 | Na2CO3 | Na2SiO3溶液 | 非金属性: C>Si | |
B | 食盐水 | 电石 | 溴水 | 乙炔可与溴发生加成反应 | |
C | 浓硝酸 | Al | NaOH溶液 | 铝和浓硝酸反应可生成NO2 | |
D | 浓硫酸 | Na2SO3 | KMnO4酸性溶液 | SO2具有还原性 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江、吉林省两省六校高一上期中化学试卷(解析版) 题型:选择题
反应3NO2+H2O=2HNO3+NO中,当有6mole-发生转移时,被氧化的物质与被还原的物质的量之比为( )
A.1∶1 B.1∶2 C.2∶1 D.3∶1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江、吉林省两省六校高一上期中化学试卷(解析版) 题型:选择题
下列对于“摩尔”的理解正确的是( )
A.摩尔是国际单位制的一个基本物理量
B.摩尔是物质的量的单位,简称摩,符号为mol
C.摩尔可以把物质的宏观数量与微观粒子的数量联系起来
D.表示6.02×1023个粒子 的集合体
的集合体
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江、吉林省两省六校高二上期中化学试卷(解析版) 题型:选择题
如图所示,反应:X(g)+3Y(g) 2Z(g)△H>0,在不同温度、不同压强(P1>P2)下,达到平衡时,混合气体中Z的百分含量随温度变化的曲线应为
2Z(g)△H>0,在不同温度、不同压强(P1>P2)下,达到平衡时,混合气体中Z的百分含量随温度变化的曲线应为
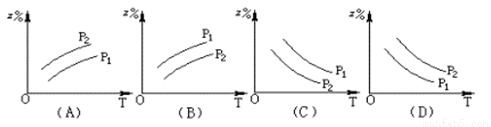
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江、吉林省两省六校高二上期中化学试卷(解析版) 题型:选择题
100℃时,将0.1 mol N2O4置于1L密闭的烧瓶中,然后将烧瓶放入100℃ 的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g)  2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是
2NO2 (g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是
①N2O4的消耗速率与NO2的生成速率之比为1:2 ;②NO2生成速率与NO2消耗速率相等;③烧瓶内气体的压强不再变化;④烧瓶内气体的质量不再变化;⑤NO2的物质的量浓度不再改变;⑥烧瓶内气体的颜色不再加深;⑦烧瓶内气体的平均相对分子质量不再变化;⑧烧瓶内气体的密度不再变化。
A.②③⑥⑦ B.①④⑧ C.只有①④ D.只有⑦⑧
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江、吉林省两省六校高二上期中化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.催化剂能够改变化学反应路径
B.升高温度提高了活化分子百分数
C.增大反应物浓度提高了活化分子百分数
D.增大压强能增大活化分子的浓度
查看答案和解析>>
科目:高中化学 来源:2017届广东省高三上第二次段考化学试卷(解析版) 题型:填空题
氮及其化合物在生产生活中有广泛应用。
(1)已知:CO可将部分氮的氧化物还原为N2。
反应Ⅰ:2CO(g)+2NO(g) N2(g)+2CO2(g) △H = -746 kJ·mol-1
N2(g)+2CO2(g) △H = -746 kJ·mol-1
反应Ⅱ:4CO(g)+2NO2(g) N2(g)+4CO2(g) △H = -1200 kJ·mol-1
N2(g)+4CO2(g) △H = -1200 kJ·mol-1
写出CO将NO2还原为NO的热化学方程式 。
(2)在一绝热恒容的容器中充入2mol CO和1mol NO2发生上述反应II,以下能说明反应达到平衡状态的是 ( )
A.容器内的总压强不在变化 B.容器内CO和NO2物质的量比不变
C.容器内气体平均密度不变 D.容器内气体温度恒定不变
(3)在密闭容器中充入5 mol CO和4 mol NO发生上述反应I,下图为平衡时NO的体积分数与温度、压强的关系。
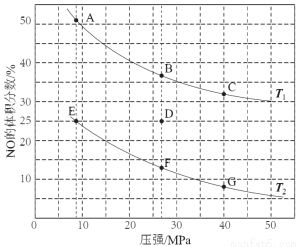
回答下列问题:
①温度:T1 T2(填“<”或“>” )。
②某温度下,在体积为2 L的密闭容器中,反应进行10分钟放出热量373 kJ,用CO的浓度变化表示的平均反应速率v(CO)= 。
③若在D点对反应容器升温的同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中A~G点中的 点
(4)某温度时,亚硝酸银AgNO2的 Ksp= 9.0×10-4、Ag2SO4的Ksp=4.0×10-5,当向含NO2-、SO42-混合溶液中加入AgNO3溶液至SO42-恰好完全沉淀(即SO42-浓度等于1.0×10-5 mol·L-1)时,c(NO2-)= mol·L-1。
(5)如右图,在酸性条件下,电解水中CN-可转化为CO2和N2,请写出阳极的电极反应式 。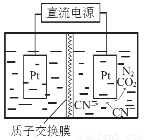
查看答案和解析>>
科目:高中化学 来源:2017届北京市海淀区高三上学期期末化学试卷(解析版) 题型:填空题
H2O2广泛应用于化学品合成、纸浆和纺织品的漂白,是环保型液体漂白剂。有研究表明,H2O2溶液的漂白性是HO2—所致。
(1) H2O2溶液显弱酸性,测得0.15 mol·L?1 H2O2溶液pH约为6。写出H2O2生成HO2—的电离方程式: 。
(2)其他条件相同时,研究不同初始pH条件下H2O2溶液的漂白效果,结果如下:

由上图可得到的结论是 ,结合平衡移动原理简述理由: 。
(3)实验发现: 若pH >11,则H2O2溶液的漂白效果随pH增大而降低。针对这一现象,继续进行实验,发现溶液中H2O2的分解与pH有关。测定不同初始pH条件下,初始浓度均为0.15 mol·L?1 的H2O2溶液发生分解反应,结果如下:
初始pH | pH = 10 | pH = 12 |
1小时后H2O2溶液浓度 | 0.13 mol·L?1 | 0.07 mol·L?1 |
1小时后pH | 没有明显变化 | 没有明显变化 |
查阅资料:HO2—+H2O2=H2O+O2+OH—。
①结合离子方程式解释1小时后pH没有明显变化的原因: 。
②从反应速率的角度分析pH过大,H2O2溶液漂白效果会降低的原因: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com