
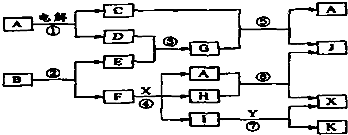
| ||
| 高温高压 |
| ||
| △ |
| ||
| 高温高压 |
| ||
| △ |
| 108 |
| 108+14x |


科目:高中化学 来源: 题型:
| A、①②③ | B、②③④ |
| C、②③④⑤ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、冰和干冰既是化合物又是纯净物 |
| B、在化学反应中,非金属单质只能做氧化剂 |
| C、盛放NaOH溶液时,使用带玻璃塞的磨口瓶 |
| D、盐卤点豆腐、江河入海口三角洲的形成等与胶体的性质无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:
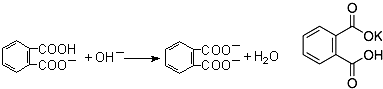
| 实验编号 | 邻苯二甲酸氢钾的质量(g) | 待测NaOH溶液的体积(mL) |
| 1 | 0.4080 | 18.20 |
| 2 | 17.10 | |
| 3 | 16.90 | |
| 4 | 17.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两个示踪试验是为了说明盐类的水解是盐中的弱的离子与水电离出的H+或OH-结合形成弱电解质的过程 |
| B、实验①中,最终同位素D将存在于NH3?DHO、D2O、D+(或D3O+)中 |
| C、实验②中,水解的离子方程式可表示为:CH3COO-+2H218O?CH3COOH+18OH- |
| D、若将NH4Cl溶于H218O和D2O的混合水中,将得到ND3?H218O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com