
电解CuSO4溶液时,若要达到以下三点要求:①阳极质量减少;②阴极质量增加;③溶液中c(Cu2+)不变。可选用的电极是
A.纯铜作阳极,含Zn、Ag的铜合金作阴极
B.含Zn、Ag的铜合金作阳极,纯铜作阴极
C.用纯铁作阳极,用纯铜作阴极
D.用石墨作阳极,用惰性电极(Pt)作阴极
 目标测试系列答案
目标测试系列答案科目:高中化学 来源:2017届内蒙古高三上第二次月考化学试卷(解析版) 题型:选择题
室温下,用0.1 mol/L HCl溶液滴定10 mL 0.1 mol/L Na2CO3溶液,滴定曲线如图所示。下列说法正确的是
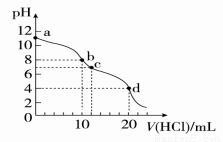
A.a点时:c(Na+)>c(CO32-)>c (HCO3-)>c(OH-)
B.b点时:3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
C.水电离程度由大到小的顺序为:a>b>c>d
D.d点时:c(H+)>c(HCO3-)=c(CO32-)
查看答案和解析>>
科目:高中化学 来源:2017届海南省高三上10月月考化学试卷(解析版) 题型:填空题
与Cl2相比较,ClO2处理水时被还原成Cl-,不生成有机氯代物等有害物质。工业上可用亚氯酸钠和稀盐酸为原料制备C lO2,反应如下:
lO2,反应如下:
NaCl O2+HCl→ClO2↑+NaCl+H2O(没有配平)
O2+HCl→ClO2↑+NaCl+H2O(没有配平)
(1)配平方程式。
 NaClO2+
NaClO2+ HCl—
HCl— ClO2↑+
ClO2↑+ NaCl+
NaCl+ H2O
H2O
(2)该反应中氧化剂和还原剂的物质的量之比_______________________。生成0.2 mol ClO2转移电子的物质的量为________mol。
(3)ClO2对污水中的Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某污水中含CN- a mg·L-1,现用ClO2将CN-氧化,只生成两种无毒气体。处理100 m3这种污水,至少需要ClO2________mol。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:实验题
某实验小组用0.50mol/LNaOH溶液和0.50mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50mol/LNaOH溶液
若实验中大约要使用245mLNaOH溶液,至少需要称量NaOH固体___________g
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如下图所示。
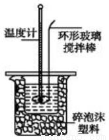
取50mLNaOH溶液和30mL硫酸溶液进行实验,实验数据如下表。
(1)写出该反应的热化学方程式为___________(中和热为57.3kJ/mol);
(2)①请填写下表中的空白:
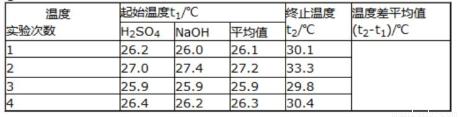
②近似认为0.50mol/LNaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃)。则中和热△H=___________(取小数点后一位)。
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是___________(填字母)
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:选择题
一定条件下存在反应:H2(g)+I2(g)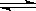 2HI(g)ΔH<0,现有三个相同的1L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1molH2和1molI2(g),在Ⅱ中充入2molHI(g),在Ⅲ中充入2molH2和2molI2(g),700℃条件下开始反应。达到平衡时,下列说法正确的是
2HI(g)ΔH<0,现有三个相同的1L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1molH2和1molI2(g),在Ⅱ中充入2molHI(g),在Ⅲ中充入2molH2和2molI2(g),700℃条件下开始反应。达到平衡时,下列说法正确的是
A.容器Ⅰ、Ⅱ中正反应速率相同
B.容器Ⅰ中反应的平衡常数大于容器Ⅲ中反应的平衡常数
C.容器Ⅱ中的气体颜色比容器Ⅰ中的气体颜色深
D.容器Ⅰ中H2的转化率与容器Ⅱ中HI的转化率之和等于1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:填空题
室温下将a mL三种一元酸分别和NaOH溶液等体积混合,实验数据如下:
组别 | c(一元酸) | c(NaOH) / mol·L-1 | 混合溶液的pH |
甲 | c(HX)=0.1 mol·L-1 | 0.1 | pH = 10 |
乙 | c(HY)=0.1 mol·L-1 | 0.1 | pH = 7 |
丙 | c(HZ)=0.1 mol·L-1 | 0.1 | pH = 9 |
(1)根据表中数据比较HX、HY、HZ三种酸的酸性由强到弱的顺序为_________,丙组实验发生反应的离子方程式为 ,所得溶液中由水电离出的c(OH-)= mol·L-1。
(2)部分实验反应过程中的pH变化曲线如下图:
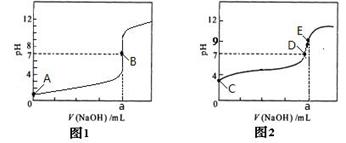
①表示乙组实验的pH变化曲线是________________(填“图1”或“图2”)
②以上两图中表示溶液恰好完全反应的点是________________。
(3)常温下,将pH=3的盐酸aL分别与下列三种溶液混合,所得溶液均呈中性。
①浓度为1.0×10-3 mol·L-1的氨水b L
②c(OH-)=1.0×10-3 mol·L-1的氨水c L
③c(OH-)=1.0×10-3 mol·L-1的氢氧化钡溶液d L。则a、b、c、d的大小关系是_________________。
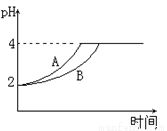
(4)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是__________(填“A”或“B”);设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2.则m1__________m2(填“<”、“=”、“>”)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:选择题
室温下,下列溶液中粒子浓度关系正确的是
A.Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S)
B.Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4)
C.Na2CO3溶液:c(Na+)+c(H+)=2c(CO32-)+c(OH-)
D.CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上期中化学卷(解析版) 题型:选择题
N2H4是一种高效清洁的火箭燃料。已知0.5molN2H4(g)完全燃烧生成氨气和气态水时,放出267kJ热量.则下列热化学方程中正确的是
A.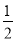 N2H4(g)+
N2H4(g)+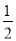 O2(g)=
O2(g)=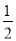 N2(g)+H2O(g) △H=+267kJ/mol
N2(g)+H2O(g) △H=+267kJ/mol
B.N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-534kJ/mol
C.N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=+534kJ/mol
D.N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJ/mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上期中化学卷(解析版) 题型:选择题
常温下,将等体积、等物质的量浓度的NH3HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7。下列关于滤液中的离子浓度关系不正确的是
A.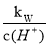 <1.0×10-7mol·L-1
<1.0×10-7mol·L-1
B.c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
C.c(H+)+c(NH4+)=c(OH-)+c(HCO3-)+2c(CO32-)
D.c(Cl-)>c(NH4+)>c(HCO3-)>c(CO32-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com