
【题目】4克氧气含有x个氧原子,则阿伏加德罗常数为
A. x/4 B. 4x C. x/8 D. 8x
科目:高中化学 来源: 题型:
【题目】用铂电极电解CuSO4溶液,当铜离子浓度降至一半时,停止通电,若使CuSO4溶液恢复到原浓度,应加入的物质是
A. CuO B. H2O C. CuSO4 D. Cu(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置进行木炭粉和浓硫酸的反应及其全部产物的检验。
已知:紫红色的酸性高锰酸钾溶液能与二氧化硫发生氧化还原反应,向酸性高锰酸钾溶液通入足量的二氧化硫气体,溶液的紫红色会完全褪去。
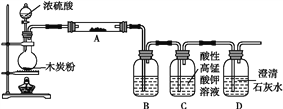
(1)组装好上述装置后,首先要进行的操作是________________。
(2)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式:_________________。
(3)装置A中试剂的化学式为______,装置B的作用是____________________________。
(4)实验时,可以说明生成二氧化碳的实验现象是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.高铁酸钾(K2FeO4)具有很强的氧化性,在生产,生活中有广泛应用。
(1)K2FeO4常用做高效水处理剂,其两种作用分别是_____。
(2)制备K2FeO4可以采用湿式氧化法,流程如图:
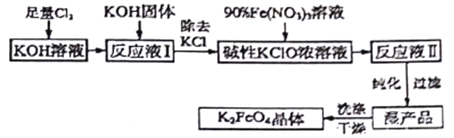
己知:① 温度较低时,Cl2通入KOH溶液生成次氯酸盐;温度较高时,Cl2通入KOH溶液生成氯酸盐;② Fe(NO3)3溶液与KClO溶液在强碱性环境中生成K2FeO4。请回答下列问题:
① 该生产工艺应在_____(填“温度较高”或“温度较低”)的情况下进行。
② 写出产生K2FeO4的离子方程式_________。
(3)实验室模拟工业电解法制取K2FeO4,装置如图.

①此装置中电源的负极是______(填“a”或“b”).
②阳极的电极反应式为______.
II.常温下,如果取0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8。试回答以下问题:
(1)混合溶液的pH=8的原因_____________(用离子方程式表示)。
(2)混合溶液中由水电离出的c(H+)_____(填“>”、“<”或“=”)0.1mol/LNaOH溶液中由水电离出的c(H+)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】晶体硅是制备太阳能电池板的主要原料,电池板中还含有硼、氮、钛、钻、钙等多种化学物质。
请回答下列问题:
(1) 区分晶体硼和无定形硼最可靠的科学方法为___________。第二周期元素的电负性按由小到大的顺序排列,B元素排在第__________位,其基态原子价层电子的电子云轮廊图为 _______________。
(2)硅酸根有多种结构形式,一种无限长链状结构如图1所示,其化学式为____________,Si原子的杂化类型为__________________。
(3) N元素位于元素周期表_____________区;基态N原子中,核外电子占据最高能级的电子云有______伸展方向。

(4)[Co(NH3)6]3+的几何构型为正八面体形,Co在中心。
①[Co(NH3)6]3+中,1个Co提供_______________个空轨道。
②若将[Co(NH3)6]3+中的两个NH3分子换成两个Cl-,可以形成_____________种不同的结构形式。
(5)—种由Ca、Ti、O三种元素形成的晶体的立方晶胞结构如图2所示。
①与Ti紧邻的Ca有___________________个。
②若Ca与O之间的最短距离为α pm,阿伏加德罗常数的值为NA,则晶体的密度ρ=______g· cm-3(用含α、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向溶液中分别通入足量的相应气体后,下列各组离子还能大量存在的是
A. 氯气:K+、Na+、SiO32-、NO3- B. 二氧化硫:Na+、NH4+、SO32-、Cl-
C. 氨气:K+、Na+、AlO2-、CO32- D. 二氧化氮:Na+、K+、S2O32-、SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com