
【题目】苯乙烯是工业上是合成树脂、离子交换树脂及合成橡胶等的重要单体,工业上可用乙苯催化脱氢方法制备苯乙烯:![]() (g)
(g)![]()
![]() (g)+H2(g) △H=+QkJ·mol-1
(g)+H2(g) △H=+QkJ·mol-1
请回答下列问题:
(1)已知乙苯(g)、苯乙烯(g)的燃烧热分别为a kJ·mol-1、bkJ·mol-1,则氢气的燃烧热为________kJ·mol-1(用含有Q、b、c的表达式表示,其中Q、b、c均大于0)。
(2)673 K时,在一恒容密闭容器中充入5 mol乙苯(g),反应达到平衡后容器内气体的压强为p1;若再充入amol的乙苯(g),重新达到平衡后容器内气体的压强为2p1,则a________5。
(3)在实际生产中,在恒压条件下常以高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应),此时乙苯的平衡转化率与水蒸气的用量、压强(p)的关系如图所示。
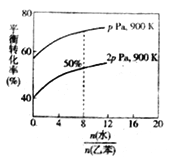
①加入水蒸气稀释剂能提高乙苯转化率的原因是___________________________。
②用平衡分压代替平衡浓度计算,其中,分压=总压×物质的量分数,则900K时的平衡常数Kp=________。
③改变下列条件,能使乙苯的反应速率和转化率一定增大的是________(填标号)。
A.恒容时加入稀释剂水蒸气 B.压强不变下,温度升至1500 K
C.在容积和温度不变下充入Ar D.选用催化效果更好的催化剂
(4)已知苯乙烯可催化氧化生成苯乙醛:![]() (g)+2O2→
(g)+2O2→![]() + CO2+H2O,若把该反应设计为酸性燃料电池,则电池负极的电极反应式为_________________,若该电池消耗标准状况下11.2 L的O2,则外电路中理论上应转移电子的物质的量为________mol。
+ CO2+H2O,若把该反应设计为酸性燃料电池,则电池负极的电极反应式为_________________,若该电池消耗标准状况下11.2 L的O2,则外电路中理论上应转移电子的物质的量为________mol。
【答案】 (Q+a-b) > 保持总压不变,充入水蒸气,容器体积增大,各组分的浓度同倍数减小,利于反应正向进行,乙苯转化率增大(或体系总压强不变时,加入稀释剂,参与反应的各物质浓度同等程度减小,相当于反应体系减压,故平衡向气体物质的量增大的方向移动,乙苯转化率增大) ![]() B
B ![]() -8e-+3H2O=
-8e-+3H2O=![]() +8H++CO2 2
+8H++CO2 2
【解析】(1)已知乙苯(g)、苯乙烯(g)的燃烧热分别为a kJ·mol-1、bkJ·mol-1,则
①C6H5-C2H5(g)+21/2O2(g)→8CO2(g)+5H2O(l) △H=-a kJ·mol-1
②C6H5-C2H3(g)+10O2(g)→8CO2(g)+4H2O(l) △H=-b kJ·mol-1
又因为③C6H5-C2H5(g)![]() C6H5-C2H3(g)+H2(g) △H=+QkJ·mol-1
C6H5-C2H3(g)+H2(g) △H=+QkJ·mol-1
所以根据盖斯定律可知①-②-③即可得到1/2O2(g)+H2(g)=H2O(l) △H=-(Q+a-b) kJ·mol-1,因此氢气的燃烧热为(Q+a-b)kJ·mol-1。
(2)根据方程式可知正反应是体积增大的可逆反应,平衡后若再充入amol的乙苯(g)相当于是增大压强平衡向逆反应方向进行,由于重新达到平衡后容器内气体的压强为2p1,即气体的物质的量是原来的2倍,而逆反应是体积减小的,所以a>5。(3)①由于保持总压不变,充入水蒸气,容器体积增大,各组分的浓度同倍数减小,有利于反应正向进行,因此乙苯转化率增大。②设乙苯的起始量是1mol,水蒸气是8mol,则根据方程式和图像可知
C6H5-C2H5(g)![]() C6H5-C2H3(g)+H2(g)
C6H5-C2H3(g)+H2(g)
起始量(mol) 1 0 0
转化量(mol) 0.5 0.5 0.5
平衡量(mol) 0.5 0.5 0.5
则900K时的平衡常数Kp=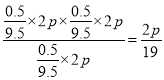 ;③A.恒容时加入稀释剂水蒸气,反应物浓度不变,反应速率和转化率均不变,A错误;B.正反应吸热,压强不变下,温度升至1500 K反应速率增大,平衡向正反应方向进行,转化率一定增大,B正确;C.在容积和温度不变下充入Ar,反应物浓度不变,反应速率和转化率均不变,C错误;D.选用催化效果更好的催化剂可以改变反应速率,但不能改变平衡状态,转化率不变,D错误,答案选B;(4)负极发生失去电子的氧化反应,则电池负极是苯乙烯失去电子,由于溶液显酸性,则负极的电极反应式为C6H5-CH=CH2-8e-+3H2O=C6H5-CHO+8H++CO2。若该电池消耗标准状况下11.2 L的O2,氧气的物质的量是0.5mol,所以外电路中理论上应转移电子的物质的量为0.5mol×4=2mol。
;③A.恒容时加入稀释剂水蒸气,反应物浓度不变,反应速率和转化率均不变,A错误;B.正反应吸热,压强不变下,温度升至1500 K反应速率增大,平衡向正反应方向进行,转化率一定增大,B正确;C.在容积和温度不变下充入Ar,反应物浓度不变,反应速率和转化率均不变,C错误;D.选用催化效果更好的催化剂可以改变反应速率,但不能改变平衡状态,转化率不变,D错误,答案选B;(4)负极发生失去电子的氧化反应,则电池负极是苯乙烯失去电子,由于溶液显酸性,则负极的电极反应式为C6H5-CH=CH2-8e-+3H2O=C6H5-CHO+8H++CO2。若该电池消耗标准状况下11.2 L的O2,氧气的物质的量是0.5mol,所以外电路中理论上应转移电子的物质的量为0.5mol×4=2mol。


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】已知在元素周期表中,A、B均为前四周期主族元素,且A位于B的下一周期。某含氧酸盐X的化学式为ABO3。请回答:
(1)若常温下B的单质为黄绿色气体。
①A在元素周期表中的位置是_______________________。
②下列说法正确的是_________(填代号)。
a.A单质的熔点比B单质的熔点低
b.A的简单离子半径比B的简单离子半径大
c.A、B元素的最高价氧化物对应的水化物都是强电解质
d.化合物X中既含有离子键又含有共价键
③400℃时,X能发生分解反应生成两种盐,其物质的量之比为1∶3,其中一种是无氧酸盐。该反应的化学方程式为_____________________________________________。
(2)若X能与稀硫酸反应,生成无色、无味的气体。
①该气体分子的电子式为______________________。
②X在水中持续加热,发生水解反应,生成一种更难溶的物质并逸出气体,反应的化学方程式为__________________________________________。
③X可用作防火涂层,其原因是:a.高温下X发生分解反应时,吸收大量的热;
b. __________________________________________(任写一种)。
(3)若X难溶于水,在空气中易氧化变质,B元素原子的最外层电子数是其电子层数的2倍。X能快速消除自来水中的C1O-,该反应的离子方程式为______________________________________。
(4)用一个化学方程式证明上述(1)、(3)两种情况下化合物X中B元素非金属性强弱________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为相互串联的甲乙两个电解池,请回答:
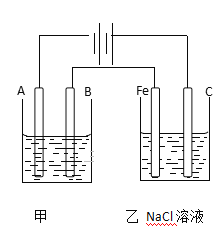
(1)甲池若为用电解精炼铜的装置,A是_________极,材料是__________,电极反应为_____________,B是___________极,材料是_______________,电极反应为_________,电解质溶液为________。
(2)若甲槽阴极增重12.8g,则乙槽阴极放出气体在标准状况下的体积为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环保部门每天通过新闻媒体向社会发布以污染物浓度为标准确定空气质量的信息.这些污染物是( )
A.二氧化硫、氮氧化物、悬浮微粒
B.二氧化硫、氮氧化物、一氧化碳
C.三氧化硫、氮氧化物、悬浮微粒
D.稀有气体、氮氧化物、悬浮微粒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据反应:2Ag+(aq)+Cu(s)=Cu2+ (aq)+2Ag(s)设计的原电池如下图所示。

请回答下列问题:
(1)电极X的材料是___________,电解质溶液Y是___________;
(2)银电极为电池的___________极,发生的电极反应为___________;X电极上发生的电极反应为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于蛋白质的叙述,错误的是( )
A. 人体血浆中含有浆细胞分泌的蛋白质 B. DNA和蛋白质是染色体的组成成分
C. rRNA能参与蛋白质的生物合成 D. 核糖体上合成的蛋白质不能在细胞核发挥作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饮用水中的![]() 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中![]() 的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将
的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将![]() 还原为N2,其化学方程式为10Al+6NaNO3+4NaOH===10NaAlO2+3N2↑+2H2O。
还原为N2,其化学方程式为10Al+6NaNO3+4NaOH===10NaAlO2+3N2↑+2H2O。
请回答下列问题:
(1)上述反应中,________元素的化合价升高,则该元素的原子________(填“得到”或“失去”)电子;而________元素的化合价降低,则该元素的原子被________(填“氧化”或“还原”)。
(2)用“双线桥法”表示反应中电子转移的方向和数目:_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com