
| A. | 常温下,在0.1mol•L-1的HNO3溶液中,由水电离出的c(H+)>$\sqrt{{K}_{w}}$ | |
| B. | 常温下,向10mL pH=3的CH3COOH溶液中加水稀释后,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$的值不变 | |
| C. | Ksp不仅与难容电解质的性质和温度有关,还与溶液中相关离子的浓度有关 | |
| D. | 常温下,浓度相同的①CH3COONa溶液、②NaClO溶液、③NaCl溶液中的c(H+):②>①>③ |
分析 A.纯水中c(H+)=c(OH-)=$\sqrt{{K}_{w}}$,稀硝酸电离出的氢离子抑制了水的电离;
B.根据醋酸根离子的水解平衡常数分析;
C.难溶物溶度积与溶液中离子浓度大小无关;
D.醋酸钠、次氯酸钠溶液呈碱性,氯化钠溶液呈中性,则NaCl溶液中氢离子浓度最大,然后结合盐的水解程度分析.
解答 解:A.0.1mol•L-1的HNO3溶液中,氢离子抑制了水的电离,则水电离出的c(H+)<$\sqrt{{K}_{w}}$,故A错误;
B.CH3COO-的水解平衡常数为KH,则$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$=$\frac{1}{{K}_{H}}$,稀释过程中醋酸根离子的水解平衡常数不变,则溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$的值不变,故B正确;
C.Ksp与难容电解质的性质和温度有关,但与溶液中相关离子的浓度无关,故C错误;
D.常温下,浓度相同的①CH3COONa溶液、②NaClO溶液、③NaCl溶液中,①②溶液呈碱性、③呈中性,则③溶液中c(H+)最大;由于HClO的酸性较弱,则NaClO溶液的碱性较强,其溶液中c(H+)较小,所以三种溶液中c(H+)大小为:③>①>②,故D错误;
故选B.
点评 本题考查较为综合,涉及难溶物溶解平衡及其影响、盐的水解原理、水的电离及其影响等知识,注意掌握盐的水解原理及其影响因素,B为易错点,可利用醋酸根离子的水解平衡常数分析.


科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ③④⑤ | C. | ⑤⑦⑧ | D. | 只有③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子键 | B. | 极性共价键 | C. | 非极性共价键 | D. | 范德华力 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

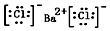 .
.| AgCl | AgI | Ag2CrO4 | |
| Ksp | 2×10-10 | 8.3×10-17 | 2×10-12 |
| 颜色 | 白 | 黄 | 砖红 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
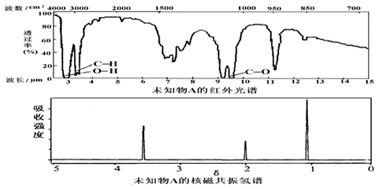
| A. | 由红光外谱可知,该有机物中至少有三种不同的化学键 | |
| B. | 由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子 | |
| C. | 若A的化学式为C3H6O,则其结构简式为CH3COCH3 | |
| D. | 仅由其核磁共振氢谱无法得知其分子中的氢原子总数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 构成原电池的条件有很多,其中一种就是利用电解质的浓度差构成“浓差电池”.当电解质中某离子的浓度越大时其氧化性或还原性越强.如图,甲池为3mol•L-1的AgNO3溶液,乙池为1mol•L-1的AgNO3溶液,A、B均为Ag电极.实验开始先闭合K2,断开K1,发现电流计指针发生偏转.下列说法不正确的是( )
构成原电池的条件有很多,其中一种就是利用电解质的浓度差构成“浓差电池”.当电解质中某离子的浓度越大时其氧化性或还原性越强.如图,甲池为3mol•L-1的AgNO3溶液,乙池为1mol•L-1的AgNO3溶液,A、B均为Ag电极.实验开始先闭合K2,断开K1,发现电流计指针发生偏转.下列说法不正确的是( )| A. | 一段时间后电流计指针将归零,此时可视为反应不再进行 | |
| B. | 当电流计指针归零后,闭合K1,断开K2后,乙池溶液浓度上升 | |
| C. | 当电流计指针归零后,闭合K1,断开K2后,乙中Ag电极质量增加 | |
| D. | 实验开始先闭合K2,断开K1,此时NO3-向B电极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖、蔗糖均可发生银镜反应 | |
| B. | 硫酸铵和乙酸铅均能使蛋白质发生变性 | |
| C. | 乙炔和乙醛均可合成聚合物 | |
| D. | 淀粉和油脂都是能发生水解反应的高分子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com