
为达到预期的实验目的,下列操作正确的是:
A. 配制10%的CuSO4溶液:将10g CuSO4·5H2O溶解在90 g水中
B. 检查右图所示装置气密性: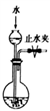
C. 称量一定质量的NaOH固体: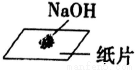
D. 比较红磷、白磷的着火点: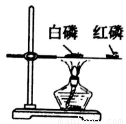
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年江苏省高二下学期学业水平模拟化学试卷(解析版) 题型:填空题
A.《化学与生活》
(1)南通是“世界长寿之都”。合理饮食,正确使用药物对人体健康至关重要。
①下列途径不属于补充人体必需的微量元素的是__________(填字母)。
a.乳制品补钙 b.海产品补碘 c.肉制品补硒
②某品牌饼干的配料标签如图所示,下列法正确的是 _________(填字母)。

a.苯甲酸钠是一种着色剂
b.小麦粉中的主要营养物质是葡萄糖
C.食用植物油在人体内水解生成高级脂肪酸和甘油
③“是药三分毒”说明药物在人体内可能产生不良反应,下列药物可能引起的不良反应叙述错误的是__________(填字母)。
a.青霉素一一过敏反应 b.阿司匹林——胃肠道反应
c.复方氢氧化铝——肠胃穿孔
(2)南通地铁2017年底开工建设,工程建设需要大量水泥、钢铁等材料。
①工业上生产水泥的主要原料是黏土和__________,地铁信息传输系统中使用的光导纤维主要成分是 __________。
②钢铁在潮湿的空气中易发生吸氧腐蚀(如右图), 正极电极反应式为_____________。
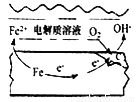
③复合材料“钙塑板”质轻、消声、隔热,以高压聚乙烯、轻质碳酸钙及少量助剂为原料压制而成,聚乙烯的结构简式为__________。
(3)环境友好型城市建设是南通城市规划(2011〜2020年)重点之一。
①2016年,南通市机动车保有量超过200万辆,在机动车尾气系统中装置催化转化器,可将尾气中的NO、CO转化为无害的CO2和__________。
②锌锰电池含有的微量汞单质可用KMnO4吸收液处理。常温下,汞的吸收率及主要反应产物与吸收液的pH的关系如下图。为降低吸收后溶液中Hg2+的浓度,吸收过程中pH> __________。当吸收液的pH<6时,Hg与KMnO4溶液反应的离子方程式为________________。
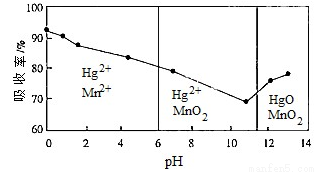
③脱硫、脫碳是指将燃煤中产生的SO2、CO2去除,减少其排放的过程。向煤中加入适量生石灰,可大大减少SO2的排放,并可回收得到_______________;CO2和H2在催化剂及髙温、高压条件下可以合成乙醇,该反应的化学方程式为_________________。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三下学期期初考试化学试卷(解析版) 题型:简答题
电镀污泥主要含有Cr2O3、NiO和Fe2O3等物质,可制备Na2Cr2O7溶液和NiSO4·6H2O晶体,实现有害物质的资源化利用。已知黄钠铁矾[NaFe3(SO4)2(OH)6]是一种浅黄色的难溶物,具有沉淀颗粒大、沉降速率快、容易过滤的特点。
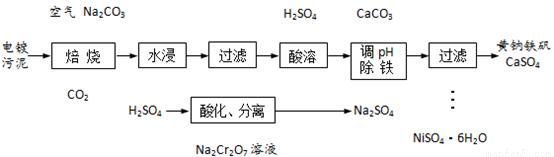
(1)焙烧时Cr2O3被氧化为Na2CrO4,该反应的化学方程式为_______________。
(2)写出酸化时CrO42-转化为Cr2O72-的离子方程式:_________________。
(3)①加入CaCO3的目的是中和溶液中的酸,调节溶液pH,提高铁的去除率。溶液pH对除铁效率影响如下图所示。
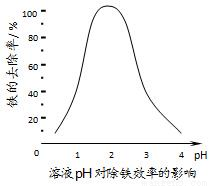
则除铁时应控制溶液的pH为____________(填序号)。
A.0.5~1.5 B.1.5~2.5 C.2.5~3.5
②除铁时发生反应的离子方程式为___________。
③若除铁时pH稍大会生成Fe(OH)3胶体,显著降低除铁效率,原因是____________。
(4)从滤液中获取NiSO4·6H2O晶体的操作为________、冷却结晶、过滤、_________、干燥。
查看答案和解析>>
科目:高中化学 来源:2017届海南省高三第七次月考化学试卷(解析版) 题型:简答题
下图是某化学研究性学习小组设计的铜与稀硝酸反应的两个实验装置图。其中装置I为甲同学设计。
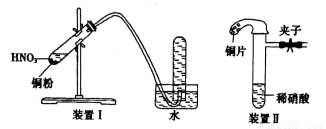
请回答下列问题:
(1)铜与稀硝酸反应的离子方程式为:__________________。
(2)装置I的试管中收集到NO,乙同学认为这也不能确定铜与稀硝酸反应生成的气体是NO,理由是______________________。于是他设计装置II,其中装铜片的是气球。
(3)研究性小组的同学共同对上述实验进行了研究,认为装置II虽然作了改进,但如果按装置II进行实验,还存在问题,需要作相应改进。
①问题一:反应速度较慢。
措施:___________或_________________。
②问题二:试管中的气体是淡棕红色,而不是无色。
措施:现将少量的固体________倒入试管,然后迅速系上装有铜的小气球。
A.Na2SO4 B. CH3COONa C. NaHCO3
③问题三:____________________。
措施:____________________。
查看答案和解析>>
科目:高中化学 来源:2017届海南省高三第七次月考化学试卷(解析版) 题型:选择题
下列实验方案合理的是:
A. 除去NaHCO3溶液中混有的Na2CO3:通入过量的二氧化碳气体
B. 清洗长期存放FeCl3溶液的试剂瓶内壁所附着的不溶物;用稀硫酸清洗
C. 分离I2和NH4Cl的固体混合物:加热混合物
D. 为了更快得到氢气:用纯锌代替粗锌与稀硫酸反应
查看答案和解析>>
科目:高中化学 来源:2017届陕西省高三上学期第二次模考化学试卷(解析版) 题型:填空题
铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛。
(1)真空碳热还原-氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下Al2O3(s)+AlCl3(g)+3C(s) =3AlCl (g)+3CO(g) △H = a kJ·mol-1
3AlCl(g)=2Al(l)+ AlCl3 (g) △H = b kJ·mol-1
①反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H=________kJ·mol-1(用含a、b的代数式表示)。
②Al4C3也是该反应过程中的一种中间产物。Al4C3 与盐酸反应(产物之一是含氢量最高的烃)的化学方程式为_______________。
③甲烷和水反应可以制水煤气(混合气体),在恒温、固定体积为V升的密闭容器中的反应微观示意图如下所示,根据微观示意图得出的结论中,正确的是_____________。


一定条件下经过t分钟达到化学平衡
a. 该反应方程式为:CH4+H2O = CO+3H2
b. 该反应平衡前后压强比为3:4
c. 该反应体系中含氢元素的化合物有3种
d. 该反应中甲烷的平衡转化率为50%
④水煤气中的H2可用于生产NH3,在进入合成塔前常用[Cu(NH3)2]Ac溶液来吸收其中的CO,防止合成塔中的催化剂中毒,其反应是:
[Cu(NH3)2]Ac(aq) + CO(g) + NH3(g)  [Cu(NH3)3]Ac·CO(aq) △H<0
[Cu(NH3)3]Ac·CO(aq) △H<0
[Cu(NH3)2]Ac溶液吸收CO的适宜生产条件应是____________________。该条件下用气体表示的平衡常数表达式为:K=______________
(2)镁铝合金(Mg17Al12 )是一种潜在的贮氢材料,一般在氩气环境中将一定化学计量比的Mg、Al 单质在一定温度下熔炼获得。该合金在一定条件下可完全吸氢得到的混合物Y(含MgH2 和Al),Y在一定条件下可释放出氢气。
①熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是_________________。
②写出镁铝合金(Mg17Al12 ) 在一定条件下完全吸氢的化学方程式 _________________。
③在6. 0 mol·L-1 HCl 溶液中,混合物Y 能完全释放出H2。1 mol Mg17 Al12 完全吸氢后得到的混合物Y 与上述盐酸完全反应,释放出H2 的物质的量为_________。
查看答案和解析>>
科目:高中化学 来源:2017届陕西省高三上学期第二次模考化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数数值,下列有关说法正确的是
A. 18.4 mol/L的浓硫酸与等质量的水混合所得溶液的物质的量浓度大于9.2 mol/L
B. 室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
C. 50 mL 14.0 mol·L-1浓硝酸与足量铜反应,转移的电子数为0.35 NA
D. 同温同压同体积下的两种气体12C18O和14N2具有的电子数相等
查看答案和解析>>
科目:高中化学 来源:2017届浙江省高三3月选考化学试卷(解析版) 题型:计算题
将6.40g CuO和Fe2O3的混合物分成两等份,其中一份在高温下用足量CO还原后,剩余固体质量为2.40g;另一份固体用200mL某浓度的盐酸恰好溶解,则:
(1)混合物中CuO和Fe2O3的物质的量之比为_______________。
(2)所用盐酸的物质的量浓度为_______________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高一下学期开学考试化学试卷(解析版) 题型:选择题
某工厂排放的废水中可能含有K+、Ag+、NH4+、Mg2+、SO42-、Cl-、NO3-、HCO3-等离子。经检测废水呈明显的碱性,则可确定该厂废水中肯定不含有的离子组合是( )
A. Ag+、K+、NO3-、HCO3- B. Ag+、NH4+、Mg2+、HCO3-
C. K+、NH4+、NO3-、SO42- D. K+、Mg2+、SO42-、Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com