
| 实验编号 | 实验前温度/℃ | 实验后温度/℃ |
| ① | 24.8 | 33.8 |
| ② | 24.7 | 33.7 |
| ③ | 24.9 | 35.9 |
分析 ①由实验①②③可知,三次实验的温度差△T均为9℃,从而根据热量Q=cm△T即可求出燃烧放出的热量;
②燃烧热是指在101Kp时,1mol可燃物完全燃烧生成稳定的氧化物时放出的热量.
解答 解:①由实验①②③可知,三次实验的温度差△T均为9℃,即温度的平均变化值为9℃,而热量Q=cm△T=4.18J•g-1•℃-1×1000g×9℃=37620J=37.62KJ,故答案为:37.62KJ;
②燃烧热是指在101Kp时,1mol可燃物完全燃烧生成稳定的氧化物时放出的热量.由于1.2g碳的物质的量n=$\frac{1.2g}{12g/mol}$=0.1mol,燃烧放出37.62KJ的热量,则硫的燃烧热为$\frac{37.62KJ}{0.1mol}$=376.2KJ/mol,故碳的燃烧热的热化学方程式为:C(s)+O2(g)=CO2(g)△H=-376.2KJ/mol,
故答案为:C(s)+O2(g)=CO2(g)△H=-376.2KJ/mol.
点评 本题考查了燃烧热的测定实验,应注意的是燃烧热是指在101Kp时,1mol可燃物完全燃烧生成稳定的氧化物时放出的热量,书写燃烧热的热化学方程式时,要使可燃物的计量数为1.


科目:高中化学 来源: 题型:解答题
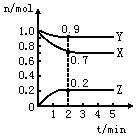 某温度时,在2L密闭容器中X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L密闭容器中X、Y、Z三种物质的量随时间的变化曲线如图所示. 2Z.
2Z.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分.
煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分.| 温度/℃ | 250 | 300 | 350 |
| K/L2•mol-2 | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | C | H2 | CO |
| △H(kJ/mol) | -393.5 | -285.8 | -283.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
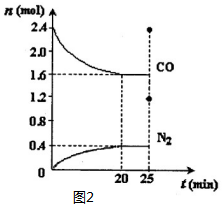 对含氮物质的研究和利用有着极为重要的意义.
对含氮物质的研究和利用有着极为重要的意义.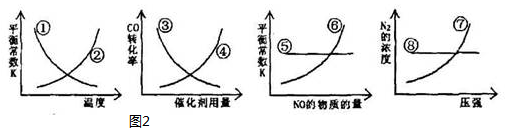
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+、K+、NO${\;}_{3}^{-}$、Cl- | B. | Na+、K+、OH-、Cl- | ||
| C. | Mg2+、Na+、OH-、SO${\;}_{4}^{2-}$ | D. | Ba2+、H+、CO${\;}_{3}^{2-}$、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油分馏可以获得乙烯 | |
| B. | 煤经过气化和液化等物理变化可转化为淸洁燃料 | |
| C. | 聚乙烯塑料制品可用于食品包装 | |
| D. | 天然气和液化气的主要成分都是甲烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com