
| 元素 | 结构或性质信息 |
| A | 原子核外有一个未成对电子,其氢化物与水分子间能形成氢键 |
| B | 原子核外M层电子数是N层电子数的4倍 |
| C | 是使用最为广泛的合金的主要成分 |
| D | 原子各内层电子均已饱和,最外层电子数为1 |
 或0.92:1或68%:74%等合理答案均给分(3分)
或0.92:1或68%:74%等合理答案均给分(3分) +6×
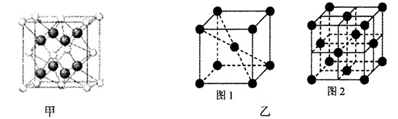
+6×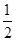 =4个;与B离子最近且等距的A离子的个数为8个。
=4个;与B离子最近且等距的A离子的个数为8个。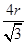 ,所以图1中铁原子的空间利用率是
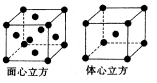
,所以图1中铁原子的空间利用率是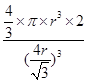 。根据图2可知b2+b2=(4r)2,解得b=
。根据图2可知b2+b2=(4r)2,解得b= ,所以图2中铁原子的空间利用率是
,所以图2中铁原子的空间利用率是 ,所以铁原子的空间利用率之比为
,所以铁原子的空间利用率之比为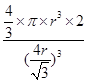 :
: =
= 。
。

科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H2SeO3 | B.HMnO4 | C.H3BO3 | D.H3PO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 元素 | 相关信息 |
| A | A原子的核外电子总数等于其基态电子层数 |
| B | B原子的最外层电子数是次外层电子数的2倍 |
| C | C的基态原子L电子层中有3个未成对电子 |
| D | D的外围电子层排布为(n+1)d3n(n+2)sn |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:推断题
 键的数目为 。
键的数目为 。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com