
【题目】常温下,浓度均为0.1molL-1的两种一元酸HX和HY溶液,用0.1molL-1的NaOH溶液分别进行滴定,滴定曲线如下图所示。下列有关叙述不正确的是


A. HX的酸性强于HY的酸性,且右图中m<1
B. 当![]() =1时,若两溶液同时升高温度,则c(Y-)/c(X-)减小
=1时,若两溶液同时升高温度,则c(Y-)/c(X-)减小
C. HY电离程度:b点大于a点
D. 当两溶液均呈中性时,c(X-)= c(Y-)
【答案】D
【解析】
通过观察图象,0.1mol/L的HX溶液的pH=1,HX为强酸,与碱等体积混合溶液呈中性;0.1mol/L的HY溶液的pH=3,HY为弱酸。
A.通过分析,HX的酸性强于HY的酸性,HY与等浓度的NaOH混合,若体积相等时,溶液显碱性,当pH=7时,加入碱的体积小于酸的体积,A正确;
B. 当![]() =1时,若两溶液同时升高温度,NaX为强碱强酸盐,c(X-)不变,c(Y-)水解程度增大,浓度减小,则c(Y-)/c(X-)比值减小,B正确;
=1时,若两溶液同时升高温度,NaX为强碱强酸盐,c(X-)不变,c(Y-)水解程度增大,浓度减小,则c(Y-)/c(X-)比值减小,B正确;
C.HY H++ Y-,向溶液中加碱,氢离子浓度减小,平衡正向移动,HY电离程度增大,C正确;
D. 当两溶液均呈中性时,HY溶液中加入的碱比HX少,c(X-)> c(Y-),D错误;
答案为D。


 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 向水中通入氯气:Cl2+H2O===2H+ + ClO+ Cl
B. 向Ca(HCO3)2溶液中滴加足量NaOH溶液:Ca2+ + 2HCO3+2OH===CaCO3↓+CO32+2H2O
C. 向明矾溶液中加过量氨水:Al3++4NH3·H2O===AlO2+4NH4++2H2O
D. 将Fe2O3溶解与足量HI溶液:Fe2O3+6H+===2Fe3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用下图表示。

(1)海洋中的氮循环起始于氮的固定,其中属于固氮作用的一步是_________(填图中数字序号)。
(2)下列关于海洋氮循环的说法正确的是__________(填字母序号)。
a. 海洋中存在游离态的氮
b. 海洋中的氮循环起始于氮的氧化
c. 海洋中的反硝化作用一定有氧气的参与
d. 向海洋排放含NO3-的废水会影响海洋中NH4+的含量
(3)有氧时,在硝化细菌作用下,NH4+可实现过程④的转化,将过程④的离子方程式补充完整:_____NH4+ + 5 O2==2 NO2- + ___ H+ + ______+ _______
(4)有人研究了温度对海洋硝化细菌去除氨氮效果的影响,下表为对10 L人工海水样本的监测数据:
温度/℃ | 样本氨氮含量/mg[ | 处理24 h[] | 处理48 h |
氨氮含量/mg | 氨氮含量/mg | ||
20 | 1008 | 838 | 788 |
25 | 1008 | 757 | 468 |
30 | 1008 | 798 | 600 |
40 | 1008 | 977 | 910 |
硝化细菌去除氨氮的最佳反应温度是______,在最佳反应温度时,48 h内去除氨氮反应的平均速率是______________mg·L-1·h-1。
(5)为了避免含氮废水对海洋氮循环系统的影响,需经处理后排放。图是电解产物氧化工业废水中氨氮(NH4+)的示意图。

①阳极的电极反应式:____________________;
②写出电解产物氧化去除氨氮的离子方程式:____________;
③若生成H2和N2的物质的量之比为3:1,则处理后废水的c(H+)将________(填“增大”、“不变”或“减小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三个热化学方程式:
(1)CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
(2)C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol
(3)H2(g)+![]() O2(g)===H2O(l) ΔH3=-285.8 kJ/mol
O2(g)===H2O(l) ΔH3=-285.8 kJ/mol
则反应2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为( )
A. -488.3 kJ/mol B. +488.3 kJ/mol
C. -2 228.9 kJ/mol D. +191 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中A为电流表。请回答下列问题:
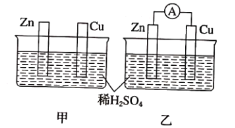
(1)以下叙述中,正确的是_______(填字母).
A 甲中锌片是负极,乙中铜片是正极 B 两烧杯中铜片表面均有气泡产生
C 两烧杯中溶液pH均增大 D 产生气泡的速度甲中比乙中慢
E 乙的外电路中电流方向Zn→Cu F 乙溶液中SO42-向铜片方向移动
(2)变化过程中能量转化的主要形式:甲为_________;乙为________。
(3)在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是____。
(4)在乙实验中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式:__________,当电路中转移0.25mo1电子时,消耗负极材料的质量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:X(s)+Y(g)![]() 2Z(g)在容积为1L密闭容器反应,下列叙述不是反应达到平衡状态的标志的是
2Z(g)在容积为1L密闭容器反应,下列叙述不是反应达到平衡状态的标志的是
①单位时间内生成1molX的同时消耗2molZ ②Z的体积分数不再变化
③体系的压强不再改变 ④Y、Z的物质的量浓度比为1:2
⑤Y的转化率不再改变的状态 ⑥混合气体的密度不再改变的状态
A. 仅①④ B. ①③④ C. ①④⑤ D. ②③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中属于吸热反应同时又是氧化还原反应的是( )
A. 灼热的炭与CO2反应 B. 铝与稀盐酸
C. Ba(OH)2·8H2O与NH4Cl反应 D. Na2O2与H2O的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯广泛用于药物、燃料、香料等工业,在中学化学实验室里常用下图装置来制备乙酸乙酯。(部分夹持仪器已略去)

已知:

制备粗品(图1)
在A 中加入少量碎瓷片,将三种原料依次加入A 中,用酒精灯缓慢加热,一段时间后在B 中得到乙酸乙酯粗品。
①浓硫酸、乙醇、乙酸的加入顺序是________________________________________,A 中发生反应的化学方程式是__________________________________________。
②A 中碎瓷片的作用是_____________________________________,长导管除了导气外,还具有的作用是_____________________________。
③B 中盛装的液体是_____________________,收集到的乙酸乙酯在_________层(填“上”或“下”)。
制备精品(图2)
将B 中的液体分液,对乙酸乙酯粗品进行一系列除杂操作后转移到C 中,利用图2 装置进一步操作即得到乙酸乙酯精品。
①C 的名称是___________________。
②实验过程中,冷却水从_________口进入(填字母);收集产品时,控制的温度应在________℃左右。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂空气电池放电时的工作原理如下图所示。下列叙述正确的是( )
A. 放电时Li+由B极向A极移动
B. 电池放电反应为4Li+O2+2H2===4LiOH
C. B电极反应式为O2+4e-===2O2-
D. 电解液a可以为氯化锂溶液
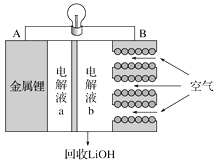
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com