
ĄūÓĆ“ß»ÆŃõ»Æ·“Ó¦½«SO2×Ŗ»ÆĪŖSO3ŹĒ¹¤ŅµÉĻÉś²śĮņĖįµÄ¹Ų¼ü²½Öč”£
£Ø1£©Ä³ĪĀ¶ČĻĀ£¬2SO2£Øg£©£« O2£Øg£©![]() 2SO3£Øg£©£»”÷H£½ mkJ”¤mol£1
2SO3£Øg£©£»”÷H£½ mkJ”¤mol£1
KµÄ“óŠ”ÓėĪĀ¶Č£ØT£©µÄ¹ŲĻµČēÓŅĶ¼ÖŠĒśĻßĖłŹ¾£¬Ōņm 0£ØĢī”°£¾”±”°=”±»ņ”°£¼”±£©£»
bµćŹ±v£ØÕż£© v£ØÄę£©£ØĢī”°£¼”±”¢”°£¾”±»ņ”°£½”±£©”£·“Ó¦µÄģŹ±ä£Ø”÷H£©½« £ØĢī”°Ōö“ó”±”¢”°¼õŠ””±»ņ”°²»±ä”±£©”£
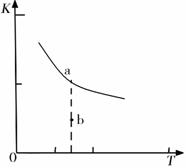
£Ø2£©Čō·“Ó¦ĪļĘšŹ¼µÄĪļÖŹµÄĮæĻąĶ¬£¬ĻĀĮŠ¹ŲĻµĶ¼“ķĪóµÄŹĒ________ (ĢīŠņŗÅ)”£
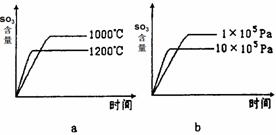
£Ø3£©Ä³ĮņĖį³§ĄūÓĆS02Ī²Ęų”¢·ĻĢśŠ¼”¢æÕĘų”¢Ė®ŗĻ³ÉĀĢ·Æ£ØFeS04”¤7H20£©£¬·“Ó¦ÖŠ×÷»¹Ō¼ĮµÄĪļÖŹŹĒ ”£
£Ø4£©½«·“Ó¦ŗóµÄ»ģŗĻĘųĢåÓĆ°±Ė®ĪüŹÕæɵƵ½ (NH4)2SO3ŗĶ(NH4)2SO4Į½Öֻƹ¤ŌĮĻ
¢Ł¶ŌÓŚ(NH4)2SO3ČÜŅŗ£¬Ä³Ķ¬Ń§Š“³öĮĖČēĻĀµÄÕżČ·¹ŲĻµŹ½£ŗ
2[c(SO32£)£«c(HSO3£)£«c(H2SO3)]=c(NH4£«)£«c(NH3”¤H2O)
Ēė·ÖĪöøĆĶ¬Ń§µÄŅĄ¾ŻŹĒ
¢ŚŌŚ(NH4)2SO4ČÜŅŗÖŠ“ęŌŚ£ŗNH4£«£«H2O![]() NH3”¤H2O£«H£«£¬ŌņøĆ·“Ó¦³£ĪĀĻĀµÄĘ½ŗā³£ŹżK= £ØŅŃÖŖ£ŗ³£ĪĀĻĀ£¬
NH3”¤H2O£«H£«£¬ŌņøĆ·“Ó¦³£ĪĀĻĀµÄĘ½ŗā³£ŹżK= £ØŅŃÖŖ£ŗ³£ĪĀĻĀ£¬![]() µÄµēĄėĘ½ŗā³£ŹżKb=1.7”Į10”Ŗ5 mol”¤L”Ŗ1£©
µÄµēĄėĘ½ŗā³£ŹżKb=1.7”Į10”Ŗ5 mol”¤L”Ŗ1£©
£Ø5£©ČżŃõ»ÆĮņĪüŹÕŗóĖłµĆµÄĮņĖį³£ÓĆĄ“ÖʱøBaSO4×÷XÉäĻßĶøŹÓŹ±µÄÄŚ·žŌģÓ°¼Į£¬ĪøĖįŗÜĒæ£ØpHŌ¼ĪŖ1£©£¬µ«·žÓĆ“óĮæBaSO4ČŌČ»ŹĒ°²Č«µÄ£¬BaSO4²»ČÜÓŚĖįµÄŌŅņŹĒ£ØÓĆČܽāĘ½ŗāŌĄķ½āŹĶ£© ”£ĶņŅ»Īó·žĮĖÉŁĮæBaCO3£¬Ó¦¾”æģÓĆ“óĮæ0.5mol£ÆLNa2SO4ČÜŅŗøų»¼ÕßĻ“Īø£¬Čē¹ūŗöĀŌĻ“Īø¹ż³ĢÖŠNa2SO4ČÜŅŗÅØ¶ČµÄ±ä»Æ£¬²ŠĮōŌŚĪøŅŗÖŠµÄBa2+ÅØ¶Č½öĪŖ mol£ÆL£Ø¼ŗÖŖ25”ꏱ£¬Ksp£ØBaSO4£©=l”Į10-10£¬Ksp£ØBaCO3£©=1”Įl0-9£©”£

| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŌĶĮĄķ½ā
| O | 2- 4 |
| O | 2- 3 |
| O | 2- 4 |
| O | 2- 4 |
| O | 2- 3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŌĶĮĄķ½ā
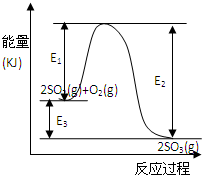 ĄūÓĆ“ß»ÆŃõ»Æ·“Ó¦½«SO2×Ŗ»ÆĪŖSO3ŹĒ¹¤ŅµÉĻÉś²śĮņĖįµÄ¹Ų¼ü²½Öč£®T”ꏱ·“Ó¦2SO2£Øg£©+O2£Øg£©?2SO3£Øg£©¹ż³ĢÖŠµÄÄÜĮæ±ä»ÆČēĶ¼ĖłŹ¾£¬»Ų“šĻĀĮŠĪŹĢā£®
ĄūÓĆ“ß»ÆŃõ»Æ·“Ó¦½«SO2×Ŗ»ÆĪŖSO3ŹĒ¹¤ŅµÉĻÉś²śĮņĖįµÄ¹Ų¼ü²½Öč£®T”ꏱ·“Ó¦2SO2£Øg£©+O2£Øg£©?2SO3£Øg£©¹ż³ĢÖŠµÄÄÜĮæ±ä»ÆČēĶ¼ĖłŹ¾£¬»Ų“šĻĀĮŠĪŹĢā£®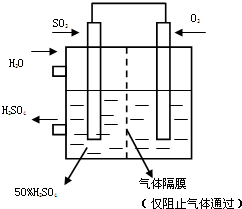
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŌĶĮĄķ½ā


| ||
| ”÷ |
| ||
| ”÷ |
| T/K | 303 | 313 | 323 |
| CA2Éś³ÉĮæ/£Ø10-1mol£© | 4.3 | 5.9 | 6.0 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
 µŖŃõ»ÆĪļŹĒ“óĘųĪŪČ¾ĪļÖ®Ņ»£¬Ļū³żµŖŃõ»ÆĪļµÄ·½·ØÓŠ¶ąÖÖ£®
µŖŃõ»ÆĪļŹĒ“óĘųĪŪČ¾ĪļÖ®Ņ»£¬Ļū³żµŖŃõ»ÆĪļµÄ·½·ØÓŠ¶ąÖÖ£®| 180”ę |
| “߻ƼĮ |
| ClO2 |
| ·“Ó¦¢ń |
| Na2SO3 |
| ·“Ó¦¢ņ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
£Ø1£©ŅŃÖŖ1.0mol”¤L”Ŗ1NaHSO3ČÜŅŗµÄpHĪŖ3.5£¬Ōņ“ĖČÜŅŗĄė×ÓÅØ¶Č“Ó“óµ½Š”µÄĖ³ŠņĪŖ £ØÓĆĄė×Ó·ūŗűķŹ¾£©”£
 £Ø2£©ÄÜÖ¤Ć÷Na2SO3ČÜŅŗÖŠ“ęŌŚĖ®½āĘ½ŗāSO32£+H2O
£Ø2£©ÄÜÖ¤Ć÷Na2SO3ČÜŅŗÖŠ“ęŌŚĖ®½āĘ½ŗāSO32£+H2O![]() HSO3£+OH£µÄŹĀŹµŹĒ £ØĢīŠņŗÅ£©”£
HSO3£+OH£µÄŹĀŹµŹĒ £ØĢīŠņŗÅ£©”£
A£®µĪČė·ÓĢŖČÜŅŗ±äŗģ£¬ŌŁ¼ÓČėH2SO4ČÜŅŗŗģÉ«ĶĖČ„
B£®µĪČė·ÓĢŖČÜŅŗ±äŗģ£¬ŌŁ¼ÓČėĀČĖ®ŗóŗģÉ«ĶĖČ„
C£®µĪČė·ÓĢŖČÜŅŗ±äŗģ£¬ŌŚ¼ÓČėBaCl2ČÜŅŗŗó²śÉś³ĮµķĒŅŗģÉ«ĶĖČ„
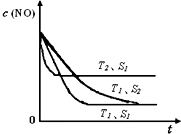
£Ø3£©¹¤ŅµÉĻĄūÓĆ“ß»ÆŃõ»Æ·“Ó¦½«SO2×Ŗ»ÆĪŖSO3£ŗ2SO2+ O2 ![]() 2SO3”£ČōijĪĀ¶ČĻĀ£¬“Ė·“Ó¦µÄĘšŹ¼ÅضČc£ØSO2£©=1.0mol”¤L”Ŗ1£¬c£ØO2£©=1.5mol”¤L”Ŗ1£¬“ļµ½Ę½ŗāŗó£¬SO2µÄ×Ŗ»ÆĀŹĪŖ50%£¬Ōņ“ĖĪĀ¶ČĻĀøĆ·“Ó¦µÄĘ½ŗā³£ŹżK£½ ”£
2SO3”£ČōijĪĀ¶ČĻĀ£¬“Ė·“Ó¦µÄĘšŹ¼ÅضČc£ØSO2£©=1.0mol”¤L”Ŗ1£¬c£ØO2£©=1.5mol”¤L”Ŗ1£¬“ļµ½Ę½ŗāŗó£¬SO2µÄ×Ŗ»ÆĀŹĪŖ50%£¬Ōņ“ĖĪĀ¶ČĻĀøĆ·“Ó¦µÄĘ½ŗā³£ŹżK£½ ”£
£Ø4£©ŌŚĖįŠŌČÜŅŗÖŠ£¬µāĖį¼Ų(KIO3)ŗĶŃĒĮņĖįÄĘæÉ·¢ÉśČēĻĀ·“Ó¦£ŗ
2IO3££«5SO32££«2H£«===I2£«5SO42££«H2O
Éś³ÉµÄµāæÉŅŌÓƵķ·ŪČÜŅŗ¼ģŃ飬øł¾Ż·“Ó¦ČÜŅŗ³öĻÖĄ¶É«ĖłŠčµÄŹ±¼äĄ“ŗāĮæøĆ·“Ó¦µÄĖŁĀŹ”£Ä³Ķ¬Ń§Éč¼ĘŹµŃéČēĻĀ±ķĖłŹ¾£ŗ
| 0.01mol”¤L£1 KIO3 ĖįŠŌČÜŅŗ(ŗ¬µķ·Ū)µÄĢå»ż/mL | 0.01mol”¤L£1 Na2SO3 ČÜŅŗµÄĢå»ż/mL | H2OµÄĢå»ż /mL | ŹµŃé ĪĀ¶Č /”ę | ČÜŅŗ³öĻÖĄ¶É«Ź±ĖłŠčŹ±¼ä/s | |
| ŹµŃé1 | 5 | V1 | 35 | 25 | |
| ŹµŃé2 | 5 | 5 | 40 | 25 | |
| ŹµŃé3 | 5 | 5 | V2 | 0 |
±ķÖŠV2=___________mL£¬øĆŹµŃéµÄÄæµÄŹĒ______________ ______”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com