
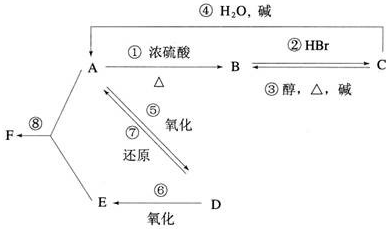
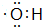 ,E为CH3COOH,含有官能团名称为羧基,有机物F为CH3COOCH2CH3,名称是:乙酸乙酯,
,E为CH3COOH,含有官能团名称为羧基,有机物F为CH3COOCH2CH3,名称是:乙酸乙酯,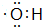 ;羧基;乙酸乙酯;
;羧基;乙酸乙酯;| 淀粉酶 |
| 酒化酶 |
| 淀粉酶 |
| 酒化酶 |
| 浓硫酸 |
| 170℃ |
| 醇 |
| △ |
| 水 |
| △ |
| Cu |
| △ |
| 催化剂 |
| △ |
| 浓硫酸 |
| △ |
| 浓硫酸 |
| 170℃ |
| 醇 |
| △ |
| 水 |
| △ |
| Cu |
| △ |
| 催化剂 |
| △ |
| 浓硫酸 |
| △ |


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
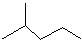
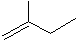
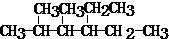
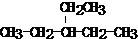
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作 | 实验现象或 预期实验现象 | 现象解释(用 离子方程式表示) | |
| 猜想② | 溶液pH=8 | ||
| 向pH=2的硫酸中 滴加Na2S2O3溶液 | 2S2O32-+2H+══S↓+SO2↑+H2O | ||
| 猜想③ | 向新制氯水中滴加少量Na2S2O3溶液 | 氯水颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:
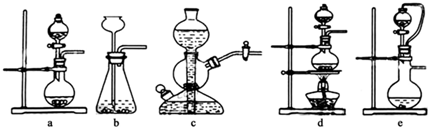
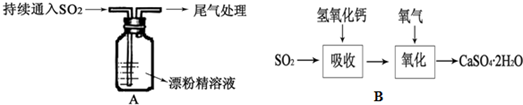
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
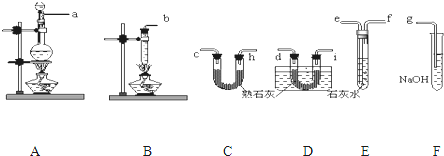
查看答案和解析>>
科目:高中化学 来源: 题型:
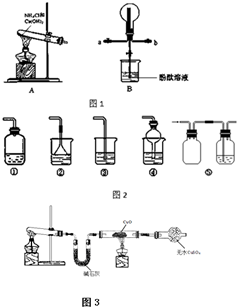 某化学实验小组同学利用如图1所示装置制备氨气,并探究氨气的性质(部分仪器已略去).
某化学实验小组同学利用如图1所示装置制备氨气,并探究氨气的性质(部分仪器已略去).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com