
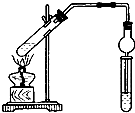
 用如图所示实验装置制取乙酸乙酯.回答以下问题:
用如图所示实验装置制取乙酸乙酯.回答以下问题:

科目:高中化学 来源: 题型:
| 物质 编号 | 甲 | 乙 | 丙 | 丁 | 物质转化关系 |
| A | Cu | CuCl2 | CuO | Cu(NO3)2 |  |
| B | Na2CO3 | NaOH | NaHCO3 | CO2 | |
| C | Fe | Fe Cl3 | Fe(OH)3 | Fe2O3 | |
| D | Al2O3 | Al(OH)3 | NaAlO2 | AlCl3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,由x g NO2和y g N2O4组成的混合气体中原子总数为3NA,则x+y=46 |
| B、1 mol氯气参加氧化还原反应,一定得到NA 或2NA个电子 |
| C、1升0.1 mol?L-1 NaBr溶液中,HBr和Br-总和为0.1NA个 |
| D、12.5 mL 16 mol?L-1浓硫酸与足量铜反应,生成SO2的分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)>c(CH3COO-)>c (OH-)>c(H+) |
| B、c(Na+)=c(CH3COO-),c(CH3COO-)>c (OH-)>c(H+) |
| C、c(Na+)>c (OH-)>c(CH3COO-)>c(H+) |
| D、c(Na+)>c (OH-)>c(H+)>c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
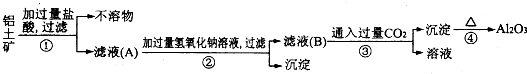
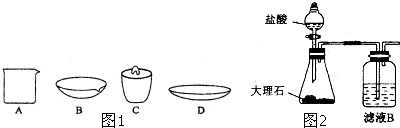
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L水中所含的分子数约为6.02×1023 | ||
B、标准状况下,aL的氧气和氮气的混合物中含有的分子数约为
| ||
| C、常温常压下,含NA个O3分子的气体的物质的量小于1 mol | ||
| D、28gCO与16gO2的体积比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | ① | ② | ③ | 实验结论 | 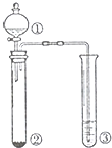 |
| A | 浓硫酸 | Cu | 品红溶液 | SO2具有漂白性 | |
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、 氧化性 | |
| C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡盐均可以生成白色沉淀 | |
| D | 浓硝酸 | Na2CO3 | Na2SiO3 溶液 | 酸性:硝酸>碳酸 >硅酸 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
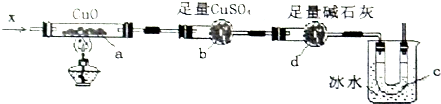
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、恒温恒容,充入NO2气体,其转化率增大 |
| B、加压(通过缩小容器体积)平衡向逆反应方向移动混合气体颜色加深 |
| C、若平衡常数增大,则可能是升高温度或减小了体系压强 |
| D、当2v正(NO)═v逆(O2)时,反应达到化学平衡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com