
阿伏加德罗常数为NA,下列说法正确的是 ( )
A.1 mol 硫酸钾中阴离子所带电荷数为NA
B.乙烯和环丙烷以任意比混合气体28 g,含有4 NA个氢原子
C.将0.1 mol氯化铁溶于1 L水中,所得溶液含Fe3+数为0.1 NA
D.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为2 NA
科目:高中化学 来源: 题型:
你认为减少酸雨产生的途径可采用的措施是( )
①少用煤作燃料 ②把工厂烟卤造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③ B.②③④⑤
C.①③⑤ D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
把煤作为燃料可通过下列两种途径。
途径Ⅰ:C(s)+O2(g)====CO2(g) ΔH=-Q1 kJ·mol-1
途径 Ⅱ:先制水煤气: C(s)+H2O(g)====CO(g)+H2(g) ΔH=+Q2 kJ·mol-1
再燃烧水煤气:2CO(g)+O2(g)====2CO2(g);2H2(g)+O2(g)====2H2O(g)
ΔH=-Q3 kJ·mol-1
试回答下列问题:
(1)途径Ⅰ放出的热量________(填“>”“=”或“<”)途径Ⅱ放出的热量。
(2)Q1、Q2、Q3的数学关系式是_____ __________。
__________。
(3)由于制取水煤气的反应里,反应物所具有的总能量____________(填“>”“=”或“<”)产物所具有的总能量,因此在化学反应里,反应物就需要_______能量才能转化为产物,因此其反应条件为_________ __________________________。
__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙三种元素均位于第三周期,其原子序数逐渐增大,甲的最高价氧化物对应的水化物是强碱,乙是地壳中含量最多的金属元素,丙是本周期中原子半径最小的元素。下列说法不正确的是
A.甲是第IA元素,丙是第VIIA元素
B.甲、丙形成的化合物是离子化合物
C.乙的最高价氧化物是两性氧化物
D.丙是元素周期表中非金属性最强的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏伽德罗常数的值。下列说法正确的是
A.28 g由C2H4和C3H6组成的混合物中含有氢原子的数目为4 NA
B.l mol Fe(NO3)3与足量HI溶液反应时转移的电子数为3NA
C.1 mol Na2O2固体中含离子总数为4NA
D.常温下,1 mol Fe与过量浓HNO3反应,转移电子的数目为3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
阿伏加德罗常数为NA,下列说法正确的是 ( )
A.1 mol 硫酸钾中阴离子所带电荷数为NA
B.乙烯和环丙烷以任意比混合气体28 g,含有4 NA个氢原子
C.将0.1 mol氯化铁溶于1 L水中,所得溶液含Fe3+数为0.1 NA
D.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
某强酸性溶液X可能含有Ba2+、Al3+、NH 、Fe2+、Fe3+、CO
、Fe2+、Fe3+、CO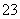 、SO
、SO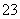 、SO
、SO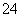 、Cl-、NO
、Cl-、NO 中的一种或几种,取该溶液进行连续实验,实验过程如下:
中的一种或几种,取该溶液进行连续实验,实验过程如下:

根据以上信息,回答下列问题:
(1)上述离子中,溶液X中除H+外还肯定含有的离子是___▲___,不能确定是否含有的离子(M)是___▲___,若要确定该M(若不止一种,可任选一种)在溶液X中不存在,最可靠的化学方法是__▲____.
(2)写出反应②的离子方程式:___▲___.
(3)通常可以利用KClO在一定条件下氧化G来制备一种新型、高效、多功能水处理剂K2FeO4.请写出制备过程中的离子方程式___▲___.
(4)假设测定A、F、I均为0.1mol,10mL X溶液中n(H+)=0.4mol,当沉淀C物质的量大于0.7mol时,溶液X中还一定含有___▲___.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com