
| A. | (NH4)2CO3溶液中加过量NaOH溶液并加热:NH4++OH-=NH3•H2O | |
| B. | 金属铝溶于氢氧化钠溶液Al+2OH-=AlO2-+H2↑ | |
| C. | 用烧碱溶液吸收氯气:Cl2+OH-=Cl-+ClO-+H2O | |
| D. | 碳酸氢钠溶液与氢氧化钠溶液混合:HCO3-+OH-═H2O+CO32- |
分析 A.二者反应生成氨气、水和碳酸钠;
B.该反应中反应物还有水,且转移电子不守恒;
C.电荷不守恒、原子不守恒;
D.二者反应生成碳酸钠和水.
解答 解:A.二者反应生成氨气、水和碳酸钠,离子方程式为NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,故A错误;
B.该反应中反应物还有水,且转移电子不守恒,离子方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑,故B错误;
C.电荷不守恒、原子不守恒,离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,故C错误;
D.二者反应生成碳酸钠和水,离子方程式为HCO3-+OH-═H2O+CO32-,故D正确;
故选D.
点评 本题考查离子方程式正误判断,为高频考点,明确离子性质及物质反应实质、离子方程式书写规则是解本题关键,注意要遵循原子守恒、电荷守恒及转移电子守恒,易错选项是B,题目难度不大.


科目:高中化学 来源: 题型:实验题
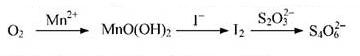
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某种验钞笔中含有碘酒溶液,遇假钞呈现蓝色,其中遇碘变蓝的物质是葡萄糖 | |
| B. | 制造新版人民币所用的棉花,优质针叶木等原料的主要成分是纤维素 | |
| C. | 古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金 | |
| D. | “青蒿一握,以水二升渍,绞取汁”,该过程是对青蒿素的提取,属于物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属原子间以共价键结合的物质都是共价化合物 | |
| B. | 金属元素和非金属元素不可能形成共价化合物 | |
| C. | 凡是能电离出离子的化合物都是离子化合物 | |
| D. | 离子化合物中可能有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 相对分子质量 | 密度(g/cm3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| 电负性值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com