
分析 在水溶液里或熔融状态下能够导电的化合物属于电解质,电解质分为强电解质和弱电解质,在水溶液中部分电离的电解质为弱电解质,在水溶液中完全电离的电解质为强电解质,弱电解质主要包括弱酸、弱碱、水等,据此进行判断.
解答 解:①Cu为单质,不属于电解质,因此不是弱电解质;
③CH3COOH是弱酸,在水溶液中部分电离,属于弱电解质;
②液态SO2 属于非电解质;
④NaHCO3在水溶液完全电离,属于强电解质;
⑤H2O存在着微弱的电离,属于弱电解质.
⑥在熔融状态下,NaCl完全电离,属于强电解质;
⑦BaSO4难溶于水,但溶于水的部分完全电离,属于强电解质;
故答案为:③⑤.
点评 本题考查强弱电解质的概念及判断,难度不大,注意“电解质是化合物,单质和混合物不是电解质,强电解质完全电离,弱电解质部分电离”.


 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是国际单位制中七个基本物理量之一 | |
| B. | CH3COOK的摩尔质量为98 g | |
| C. | 1 mol CH3COOK含有2 mol氧 | |
| D. | 1 mol CH3COOK含有3×6.02×1023个H |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
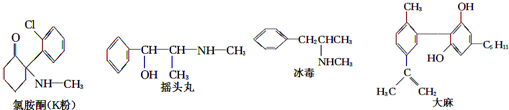
| A. | 1molK粉最多可以与3molH2发生加成反应 | |
| B. | 冰毒能与盐酸反应 | |
| C. | 适当条件下,1mol大麻最多可与2mol Br2发生反应 | |
| D. | 摇头丸具有两性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②③④ | C. | ②④ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应中,反应物总能量与生成物总能量 | |
| B. | 化学反应中,反应物总质量与生成物总质量 | |
| C. | 溶液中,稀释前溶质质量与稀释后溶质质量 | |
| D. | 在化合物中,正化合价总数与负化合价总数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠的电子式: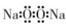 | B. | 次氯酸分子的结构式:H-Cl-O | ||
| C. | C60和石墨互为同位素 | D. | 具有10个中子的氧原子:${\;}_{8}^{18}$O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度(mol•L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 序号 | 符合的条件 | 物质的化学式或名称 |
| (1) | 混合物 | |
| (2) | 电解质,但熔融状态下并不导电 | |
| (3) | 电解质,但难溶于水 | |
| (4) | 非电解质 | |
| (5) | 既不是电解质,也不是非电解质,但本身能导电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com