
 锰(Mn)是维持人体正常生命活动所必须的微量元素,含锰化合物在生产、生活中也被广泛应用.结合图中信息,下列叙述正确的是( )
锰(Mn)是维持人体正常生命活动所必须的微量元素,含锰化合物在生产、生活中也被广泛应用.结合图中信息,下列叙述正确的是( )| A. | 锰原子核内有25个质子,一个锰原子的质量是54.94g | |
| B. | 锰原子核外有4个电子层,其化学性质由最内层电子决定 | |
| C. | MnO2属于氧化物,在H2O2分解制O2的实验中做催化剂 | |
| D. | KMnO4为紫黑色固体,易溶于水、汽油等溶剂,形成紫红色溶液 |
分析 左上角数字25为原子序数,Mn为元素符号,锰为元素名称,下方的数字54.94为元素的相对原子质量.
A.原子序数等于原子质子数,Mn的摩尔质量为54.94g/mol;
B.原子化学性质由最外层电子决定;
C.氧化物是指含有2种元素且氧元素为负价的化合物,在过氧化氢分解中二氧化锰起催化剂作用;
D.KMnO4为紫黑色固体,难溶于汽油.
解答 解:左上角数字25为原子序数,Mn为元素符号,锰为元素名称,下方的数字54.94为元素的相对原子质量.
A.原子序数等于原子质子数,锰原子核内有25个质子,Mn的摩尔质量为54.94g/mol,NA个锰原子的质量是54.94g,故A错误;
B.由原子结构示意图可知,锰原子核外有4个电子层,其化学性质由由最外层电子决定,故B错误;
C.MnO2含有Mn、O两种元素且O元素表现负价,属于氧化物,在H2O2分解制O2的实验中做催化剂,故C正确;
D.KMnO4为紫黑色固体,易溶于水形成紫红色溶液,难溶于汽油,故D错误,
故选:C.
点评 本题考查元素周期表、原子结构与性质等,旨在考查学生对基础知识的理解掌握.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 由C(石墨)═C(金刚石)△H>0,可知金刚石比石墨稳定 | |
| C. | 在稀溶液 中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| D. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 饮用水安全在灾后重建中占有极为重要的地位,为防止灾后疫病要使用大量的各种消毒液,如NaClO溶液,某学习小组对消毒液次氯酸钠(NaClO)的制备与性质进行研究.
饮用水安全在灾后重建中占有极为重要的地位,为防止灾后疫病要使用大量的各种消毒液,如NaClO溶液,某学习小组对消毒液次氯酸钠(NaClO)的制备与性质进行研究.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
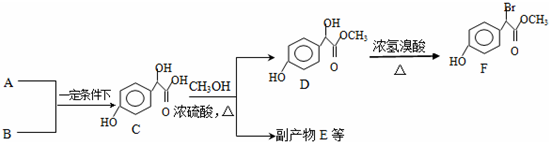
 .
. 中①、②、③(从左到右编号)3个-OH的酸性由强到弱的顺序是:③>①>②.
中①、②、③(从左到右编号)3个-OH的酸性由强到弱的顺序是:③>①>②. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在Na2S溶液中滴入酚酞试液,呈红色 | |
| B. | 升高温度能使FeCl3溶液中的H+浓度增大 | |
| C. | 一切钾盐、钠盐、硝酸盐都不发生水解 | |
| D. | 醋酸盐溶于水能发生水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com