
【题目】盐MN溶于水存在如图过程,下列有关说法中不正确的是

A. 该过程可表示MN的水解过程
B. 相同条件下结合H+的能力N->OH-
C. 该过程使溶液中的c(OH-)>c(H+)
D. 溶液中存在c(HN)=c(OH-)-c(H+)
科目:高中化学 来源: 题型:
【题目】已知有机物A分子由C、H、O三种元素组成,其相对分子质量为120,0.1molA在足量的氧气中充分燃烧后生成0.8mol CO2 和7.2g H2O;A可以发生银镜反应,其苯环上的一卤代物有三种。
(1)A的分子式是_________,A中含氧官能团的名称是________________,A的结构简式是_______________。
已知:I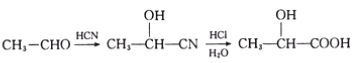
II.
现有如下转化关系:
![]()
其中D能使溴的四氯化碳溶液褪色,F继续被氧化生成G,G的相对分子质量为90。
(2)C可能具有的化学性质是____________。(请填字母)
① 能与H2发生加成反应;② 能在碱性溶液中发生水解反应;③ 能与甲酸发生酯化反应;④ 能与Ag(NH3) 2OH溶液发生银镜反应;⑤能与氢氧化钠溶液反应
A.①②③ B.①③⑤ C.①②③⑤ D.②③④⑤
(3)① 写出C→D的化学反应方程式是________________________________________;反应类型是____________。
②在催化剂条件下,C生成高聚物的化学方程式是_________________________________。
(4)请写出化合物C可能的同分异构体结构简式是___________________________。须同时符合下列条件:
①属于酯类化合物;
②遇三氯化铁溶液显紫色;
③与新制氢氧化铜悬浊液共热可生成红色沉淀;
④苯环上的一卤代物只有一种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应 A + 3B![]() 2C + 2D 在四种不同条件下的反应速率为: (1)v(A)=0.03mol/(L·s) (2)v(B)=3.6mol/(L·min) (3)v(C)=0.04mol/(L·s) (4)v(D)=2.7mol/(L·min),则该反应速率的快慢顺序为 ( )
2C + 2D 在四种不同条件下的反应速率为: (1)v(A)=0.03mol/(L·s) (2)v(B)=3.6mol/(L·min) (3)v(C)=0.04mol/(L·s) (4)v(D)=2.7mol/(L·min),则该反应速率的快慢顺序为 ( )
A. (2)>(4)>(3)>(1) B. (1)>(4)>(2)= (3)
C. (4)>(3)=(2)>(1) D. (2)>(3)= (4)>(1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表是元素周期表的一部分,参照元素在表中的位置,回答下列问题:
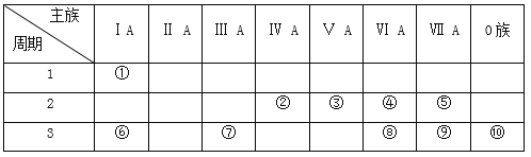
(1)上述元素最高价氧化物对应水化物中,酸性最强的是__________(填化学式),碱性最强的是__________(填化学式),显两性的是__________(填名称)。
(2)气态氢化物中,最稳定的是__________(填化学式),④⑧形成的氢化物中沸点最高的是__________(填化学式),原因是__________________。
(3)④分别和①、⑥两种元素的原子按1:1组成的常见化合物的电子式分别为__________和_______。用电子式表示②和④的三原子分子的形成过程____________。
(4)④⑥⑦⑨的简单离子半径由大到小的顺序为__________(用离子符号和“>”表示)。
(5)⑥和⑦的最高价氧化物对应水化物之间发生反应的化学方程式___________。
(6)为了证明⑥和⑦两种元素的金属性强弱,下列说法或实验能提供证据的是______。
A.比较两种元素的单质的熔点、沸点高低
B.将两种元素的单质分别与冷水反应,观察反应的剧烈程度
C.比较两种元素的最高价氧化物对应的水化物的碱性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在, CrO42-和Cr2O72-在溶液中可相互转化2CrO42-+2H+![]() Cr2O72-+H2O。 室温下,初始浓度为1.0mol/L的Na2CrO4溶液中c(Cr2O72-)随c(H+)的变化如图所示,回答下列问题:
Cr2O72-+H2O。 室温下,初始浓度为1.0mol/L的Na2CrO4溶液中c(Cr2O72-)随c(H+)的变化如图所示,回答下列问题:

(1)由图可知,随着溶液酸性增强,CrO42-的平衡转化率__________(填“增大“减小”或“不变”)。根据A(1.0,0.25)点数据,计算出该转化反应的平衡常数为__________。
(2)升高温度,溶液中CrO42-的平衡转化率减小,则该反应的ΔH_______0(填“大于”“小于”或“等于”)。
(3) 在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl-,利用Ag+与CrO42-生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好完全沉淀(浓度等于1.0×10-5mol/L)时,溶液中c(Ag+)为_______ mol/L,此时溶液中c(CrO42-)等于__________ mol/L。 (已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质溶液的判断正确的是
A. 100℃时,NaCl溶液的pH<7,则溶液呈酸性
B. 将pH=4的 CH3COOH溶液加水稀释,溶液中所有离子的浓度均减小
C. 常温下,CH3COOH分子可能存在于pH>7的碱性溶液中
D. 向氨水中加入盐酸至中性,溶液中![]() 一定增大
一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有二氧化硫—空气质子交换膜燃料电池,其原理如图所示。下列说法不正确的是
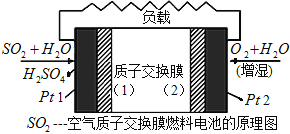
(注:质子指H+,质子交换膜仅允许H+通过)
A. Pt2电极附近发生的反应为:O2+4e-+2H2O=4OH-
B. 该电池工作时质子从Pt1电极经过内电路流到Pt2电极
C. Pt1电极附近发生的反应为:SO2+2H2O-2e-=SO42-+4H+
D. 该电池实现了制硫酸、发电、环保三位一体的结合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭系统中有反应C(s)+CO2(g)![]() 2CO(g),能使反应速率加快的措施是
2CO(g),能使反应速率加快的措施是
①通过减小容器体积增大压强 ②升高温度③将炭粉碎 ④通入CO2 ⑤增加炭的量 ⑥恒容条件下通入N2
A.①②③④B.①②④⑥C.①②③⑥D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】晶体硅是一种重要的非金属材料,有科学家认为硅是“21世纪的能源”、“未来的石油”。
(1)工业上生产纯硅的工艺流程如下:
![]()
石英砂的主要成分是SiO2,在制备粗硅时,焦炭的作用是__________(填“氧化剂”或“还原剂”);在该反应中,若消耗了3.0 g SiO2 ,则转移电子的总数为_______________。
(2)某实验室利用SiHCl3(沸点33.0 ℃)与过量H2在1 000 ℃~1 100 ℃反应制得纯硅。已知SiHCl3能与H2O强烈反应,在空气中易自燃。装置如图所示(热源及夹持装置略去)。
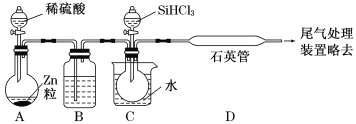
①装置B中的试剂是___________。装置C中的烧瓶需要加热,其目的是_________________。
②反应一段时间后,装置D中观察到的现象是______________________;装置D中发生反应的化学方程式为___________________________________。
③为检验产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需要加入的试剂有______(填字母)。
a.碘水 b.氯水 c.Na2SO3溶液 d.KSCN溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com