
 依据事实,写出下列反应的热化学方程式.
依据事实,写出下列反应的热化学方程式.| O═O | H-H | H-O(g) | |
| 1mol化学键断裂时需要吸收的能量/kJ | 496 | 436 | x |
分析 (1)根据n=$\frac{m}{M}$计算出2g SiH4的物质的量,然后计算出1mol甲硅烷燃烧放出的热量,结合化学方程式书写热化学方程式,注意物质的聚集状态和反应热的单位等问题;
(2)根据反应热等于反应物总能量减去生成物总能量计算反应热并书写热化学方程式,注意反应物的物质的量和生成物的聚集状态,由图可以看出,$\frac{1}{2}$molN2(g)+$\frac{3}{2}$molH2(g)的能量为akJ,1molNH3(g)的能量为bkJ,所以$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)=NH3(g);△H=(a-b)kJ/mol,
而1mol的NH3(g)转化为1mol的NH3(l)放出的热量为ckJ,所以有:$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)=NH3(l);△H=(a-b-c)kJ/mol,
即:N2(g)+3H2(g)=2NH3(1);△H=2(a-b-c)kJ•mol-1,据此进行分析;
(3)1g氢气完全燃烧生成液态水时放出热量143kJ,故2mol氢气燃烧生成2mol液态水时放出热量为$\frac{2mol×2g/mol}{1g}$×143kJ=572kJ,18g水蒸气变成液态水放出44kJ的热量,2mol液态水变为气态水吸收的热量为$\frac{2mol×18g/mol}{18g}$×44kJ=88kJ,故2mol氢气燃烧生成2mol气态水时放出热量为572kJ-88kJ=484kJ,反应物的总键能-生成物的总键能=反应热,据此计算.
解答 解:(1)n(SiH4)=$\frac{2g}{32g/mol}$=$\frac{1}{16}$mol,则1molSiH4燃烧放出的热量为:89.2kJ×16=1427.2kJ,该反应的化学方程式为:SiH4+2O2=SiO2+2H2O,则热化学方程式为:SiH4(g)+2O2(g)=SiO2(g)+2H2O(l)△H=-1427.2kJ/mol,
故答案为:SiH4(g)+2O2(g)=SiO2(g)+2H2O(l)△H=-1427.2kJ/mol;
(2)根据反应热等于反应物总能量减去生成物总能量计算反应热并书写热化学方程式,注意反应物的物质的量和生成物的聚集状态,由图可以看出,$\frac{1}{2}$molN2(g)+$\frac{3}{2}$molH2(g)的能量为akJ,1molNH3(g)的能量为bkJ,所以$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)=NH3(g);△H=(a-b)kJ/mol,
而1mol的NH3(g)转化为1mol的NH3(l)放出的热量为ckJ,所以有:$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)=NH3(l);△H=(a-b-c)kJ/mol,
故热化学方程式为N2(g)+3H2(g)=2NH3(1);△H=2(a-b-c)kJ•mol-1,
故答案为:N2(g)+3H2(g)=2NH3(1);△H=2(a-b-c)kJ•mol-1;
(3)1g氢气完全燃烧生成液态水时放出热量143kJ,故2mol氢气燃烧生成2mol液态水时放出热量为$\frac{2mol×2g/mol}{1g}$×143kJ=572kJ,18g水蒸气变成液态水放出44kJ的热量,2mol液态水变为气态水吸收的热量为$\frac{2mol×18g/mol}{18g}$×44kJ=88kJ,故2mol氢气燃烧生成2mol气态水时放出热量为572kJ-88kJ=484kJ,故热化学方程式为2H2(g)+O2(g)=2H2O(g)△H=-484kJ/mol,所以2×436kJ/mol+496kJ/mol-4xkJ/mol=-484kJ/mol,解得x=463,
故答案为:463.
点评 本题考查了热化学方程式的书写,题目难度不大,明确热化学方程式的书写原则即可解答,试题侧重考查学生的分析能力及灵活应用基础知识的能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子结构示意图 ,可以表示12C原子或13C原子 ,可以表示12C原子或13C原子 | |
| B. | 乙烯的结构简式:CH2CH2 | |
| C. | 次氯酸的电子式 | |
| D. | CO2的比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲的体积比乙的体积大 | B. | 甲的分子数比乙的分子致少 | ||
| C. | 甲的压强比乙的压强大 | D. | 甲的摩尔体积比乙的华尔体积大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{6a}{b}$ mol•L-1 | B. | $\frac{3a}{b}$ mol•L-1 | C. | $\frac{3b}{a}$ mol•L-1 | D. | $\frac{b}{a}$ mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 反应类型加聚反应
反应类型加聚反应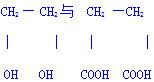 的聚合反应n HOCH2CH2OH+n HOOCCH2CH2COOH
的聚合反应n HOCH2CH2OH+n HOOCCH2CH2COOH 
 +(2n-1)H2O反应类型缩聚反应
+(2n-1)H2O反应类型缩聚反应 反应类型取代反应
反应类型取代反应查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

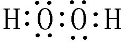 ,用电子式表示Y的形成过程
,用电子式表示Y的形成过程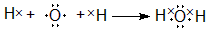 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com