
在3种不同条件下,分别向容积为2 L的恒容密闭容器中充入2 mol A和1 mol B,发生反应如下:2A(g)+B(g)2D(g)
ΔH=-Q kJ·mol-1。相关条件和数据见下表:
| 实验编号 | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
| 反应温度/℃ | 800 | 800 | 850 |
| 达平衡时间/min | 40 | 10 | 30 |
| c(D)平衡/mol·L-1 | 0.5 | 0.5 | 0.15 |
| 反应的能量变化/kJ | Q1 | Q2 | Q3 |
下列说法正确的是( )
A.可用压强或密度是否发生变化判断上述反应是否达到平衡
B.实验Ⅱ可能隐含的条件是使用催化剂,实验Ⅲ达平衡时v(D)为0.005 mol·L-1·min-1
C.由表中信息可知Q>0,并有Q3<Q2=Q1=Q
D.实验Ⅰ达平衡后,恒温下再向容器中通入1 mol A和1 mol D,达平衡时c(D)为1.0 mol·L-1
答案 BD
解析 A项,不能用密度不变判断上述反应是否达到平衡;B项,Ⅰ 和 Ⅱ 达到平衡时,c(D)相等,隐含的条件是使用催化剂,实验Ⅲ达到平衡时v(D)= =0.005 mol·L-1·min-1;C项,升温 c(D)减小,平衡左移,Q>0,Q3<Q2=Q1<Q;
=0.005 mol·L-1·min-1;C项,升温 c(D)减小,平衡左移,Q>0,Q3<Q2=Q1<Q;
D项, 2A(g) + B(g)2D(g)
原平衡(mol·L-1) 0.5 0.25 0.5
K=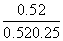 =4
=4
当再加入0.5 mol·L-1的A和0.5 mol·L-1的D时
c(A)=1 mol·L-1
c(B)=0.25 mol·L-1
c(D)=1 mol·L-1
此时Q=4, 平衡不移动,所以c(D)为1.0 mol·L-1。


科目:高中化学 来源: 题型:
100 mL 2 mol/L 盐酸与足量锌粒反应,能加快该反应速率又不影响生成氢气的量的物质是
A.6 mol/L盐酸 B.醋酸钠固体 C.硫酸铜溶液 D.金属钠
查看答案和解析>>
科目:高中化学 来源: 题型:
液晶高分子材料应用广泛。新型液晶基元——化合物Ⅳ的合成线路如下:
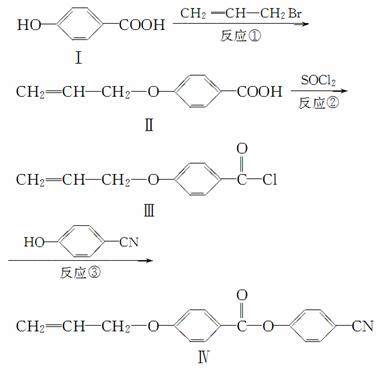
(1)化合物Ⅰ的分子式为________,1 mol化合物Ⅰ最多可与________ mol NaOH反应。
(2)CH2===CH—CH2Br与NaOH水溶液反应的化学方程式为________________________(注明条件)。
(3)化合物Ⅰ的同分异构体中,苯环上一溴代物只有两种且能发生银镜反应的化合物有多种,写出其中一种同分异构体的结构简式:________________________________________________________________________。
(4)下列关于化合物Ⅳ的说法正确的是________(填字母)。
A.属于烯烃
B.能与FeCl3溶液反应显紫色
C.一定条件下能发生加聚反应
D.能使溴的四氯化碳溶液褪色
(5)反应③的反应类型是________。在一定条件下,化合物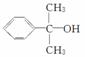 也可与Ⅲ发生类似反应生成有机物Ⅴ。Ⅴ的结构简式是__________。
也可与Ⅲ发生类似反应生成有机物Ⅴ。Ⅴ的结构简式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
铃兰醛具有甜润的香味,常用作肥料、洗涤剂和化妆品的香料。合成铃兰醛的路线如下图所示(部分试剂和条件未注明):
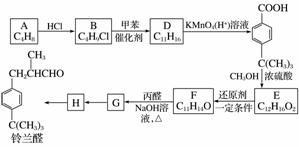
已知:ⅰ.R1—CHO+R2—CH2—CHO
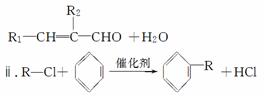
请回答:
(1)由A生成B的反应类型是__________。
(2)D的结构简式是__________。
(3)生成E的化学方程式是______________________。
(4)F能发生银镜反应,F的结构简式是____________________________________________。
(5)下列有关G的叙述中,不正确的是______(填字母)。
a.G分子中有4种不同化学环境的氢原子
b.G能发生加聚反应、氧化反应和还原反应
c.1 mol G最多能与4 mol H2发生加成反应
(6)由H生成铃兰醛的化学方程式是______________。
(7)F向G转化的过程中,常伴有分子式为C17H22O的副产物K产生。K的结构简式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
高炉炼铁过程中发生的反应: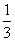 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)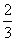 Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下表所示,下列说法不正确的是( )
Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下表所示,下列说法不正确的是( )
| 温度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
A.ΔH<0
B.该反应的平衡常数表达式是K=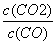
C.其他条件不变,向平衡体系充入CO2气体,K值减小
D.其他条件不变,升高温度,可以降低CO的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
有6.85 g铅的氧化物,用足量的CO在高温下将其还原,把生成的全部CO2通入到足量的澄清的石灰水中得到4.00 g 固体沉淀物,这种铅的氧化物的化学式为( )
A.PbO
B.PbO2
C.Pb3O4
D.Pb3O4和PbO2的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
4.6 g铜镁合金完全溶解于100 mL密度为1.40 g·mL-1、质量分数为63%的浓硝酸中,得到4 480 mL NO2和336 mL N2O4的混合气体(标准状况),向反应的溶液中加入1.0 mol·L-1 NaOH溶液至离子恰好全部沉淀时,下列说法不正确的是( )
A.该合金中铜与镁的物质的量之比是69∶46
B.该浓硝酸中HNO3的物质的量浓度是14.0 mol·L-1
C.产生沉淀8.51 g
D.离子恰好完全沉淀时,加入NaOH溶液的体积是230 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25℃时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13.0,则下列说法不正确的是( )
A.所得溶液中c(H+)=1.0×10-13 mol·L-1
B.所得溶液中由水电离产生的c(OH-)=1×10-13 mol·L-1
C.所加烧碱溶液的pH=13.0
D.所得溶液中c(Mg2+)=5.6×10-10 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com