
在下列各组溶液中,离子一定能大量共存的是
A.加入KSCN溶液显红色的溶液:K+、NH4+、Cl-、I-
B.通入SO2气体后的溶液:Na+、Ca2+、K+、Cl-
C.0.1 mol·L-1的Na2CO3溶液:K+、Ba2+、NO3-、Cl-
D . 1mol/LNH4Al(SO4)2的溶液:K+、Ca2+、HCO3-、Cl-
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
草木灰是柴草燃烧后形成的灰肥,是一种质地疏松的热性速效肥。其中富含钾盐,主要成分为碳酸钾,还含有少量的氯化钾和硫酸钾。先从草木灰中提取钾盐,并用实验检验其中的SO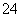 和Cl-。
和Cl-。
(1)此实验的操作顺序如下:①称量样品;②溶解沉降;③__________;④__________;⑤冷却结晶。
(2)用托盘天平(指针向上)称量样品时,若指针偏向右边,则表示( )
A.左盘重,样品轻
B.左盘轻,砝码重
C.右盘重,砝码轻
D.右盘轻,样品重
(3)在进行第③步操作时,有时可能要重复进行,这是由于_____________________。
(4)在进行第③、④步操作时,都要用到玻璃棒,其作用分别是
③________________________________________________________________________,
④________________________________________。
(5)将制得的少量晶体放入试管中,加蒸馏水溶解后分成两份,分别装在两支试管中。在第一支试管中加入足量的盐酸,再加入BaCl2溶液,观察到有__________生成,证明溶液中有__________(填离子符号)。在第二支试管中加入足量的稀硝酸,再加入AgNO3溶液,观察到有__________生成,证明溶液中有__________(填离子符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
同温、同压下,下列有关比较等质量的二氧化硫气体和二氧化碳气体的叙述中正确的是( )
A.密度比为16:11 B.密度比为11:16 C.体积比为16:11 D.体积比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向某溶液中滴加盐酸酸化的氯化钡溶液 | 出现白色沉淀 | 该溶液中一定存在SO42 |
| B | 向苏打和小苏打溶液中分别加入盐酸 | 均冒气泡 | -两者均能与盐酸反应 |
| C | 将可调高度的铜丝伸入到稀HNO3中 | 溶液变蓝 | Cu与稀HNO3发生置换反应 |
| D | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置 | 上层溶液 显紫红色 | 氧化性:Fe3+>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质中前者为电解质、后者属于非电解质的是
A. CaO 、C2H5OH B.、 HCl、 CH3COOH
C. H2S、 BaSO4 D、 NH3·H2O、Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
下图中A~J分别代表相关反应的一种物质.已知A分解得到等物质的量的B、C、D,图中有部分生成物未标出.请填写以下空白:
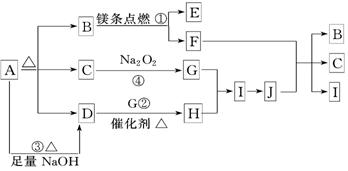 (1)写出A的分子式
(1)写出A的分子式
B的电子式 :
D分子的空间构型:
(2)写出反应②的化学方程式:
(3)写出反应③的离子方程式:___________________________________________.
(4)J与F反应的化学方程式:________________________________________________.
(5)在反应 ④ 中,当生成标准状况下4. 48L G时,转移电子数为________ mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
氢化铝钠(NaAlH4)是最有研究应用前景的络合金属氢化物,氢化铝钠储放氢时发生反
应:3NaAlH4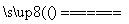 Na3AlH6+2Al+3H2↑。下列说法正确的是( )
Na3AlH6+2Al+3H2↑。下列说法正确的是( )
A. NaAlH4中氢元素为+1价
B.每生成11. 2 L(标准状况下)H2,转移2NA个电子
C.反应中氧化产物与还原产物的物质的量之比为1: 1
D.在反应中有50%的氢被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
在一容积为2 L的密闭容器内加入0.2 molA和0.6 molB,在一定条件下发生反应:A(s)+3B(g) 2C(s)+3D(g) 已知该反应在不同温度下的平衡常数如下表:
2C(s)+3D(g) 已知该反应在不同温度下的平衡常数如下表:
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 64.0 | 50.7 | 42.9 |
请回答下列问题:
(1)该反应的平衡常数表达式K= ,ΔH 0(填“>”或“<”)。
(2)1000 ℃时,4 min后达到平衡.求4 min内D的平均反应速率v(D)= ,B的平衡转化率为 ,平衡时B的体积分数 。
(3)欲提高⑵中B的平衡转化率,可采取的措施是( )
A.减少C的量 B.增加A的量
C.移出部分D D.降低反应温度
E.减小容器的容积 F.加入合适的催化剂
(4)下列说法中能说明反应已达到平衡状态的是( )
A.容器内混合气体的压强不随时间变化而变
B.B的速率不随时间的变化而变化
C.c(B)︰c(D)=1︰1
D.混合气体的密度保持不变(M(B)≠M(D))
查看答案和解析>>
科目:高中化学 来源: 题型:
离子方程式Ba2++SO42-===BaSO4↓它可能表示( )
①可溶性钡盐溶液与可溶性硫酸盐溶液之间的反应 ②氢氧化钡溶液与可溶性硫酸盐溶液之间的反应 ③稀硫酸与可溶性钡盐溶液之间的反应 ④氢氧化钡溶液与稀硫酸反应
A.①② B.①②④
C.②③ D.①②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com