
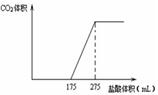
 取一定质量NaHCO3和Na2O2的固体混合物放入一密闭容器中加热至250℃,充分反应后排出所有气体.将反应后的固体分成相同的两份,将其中一份投入到足量的BaCl2溶液中,最后可得到3.94g沉淀.另一份溶于适量的水,无气体放出,再向水溶液中缓慢逐滴加入某物质的量浓度的盐酸,产生气体与所加盐酸体积之间的关系如图所示.试回答下列问题:
取一定质量NaHCO3和Na2O2的固体混合物放入一密闭容器中加热至250℃,充分反应后排出所有气体.将反应后的固体分成相同的两份,将其中一份投入到足量的BaCl2溶液中,最后可得到3.94g沉淀.另一份溶于适量的水,无气体放出,再向水溶液中缓慢逐滴加入某物质的量浓度的盐酸,产生气体与所加盐酸体积之间的关系如图所示.试回答下列问题:分析 Na2O2与等物质的量的NaHCO3混合后,在密闭容器中充分加热,可能发生的反应有:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,
2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,CO2+2NaOH=Na2CO3+H2O,根据二者的物质的量的关系来判断残留固体.
(1)据图象数据来确定组成;
(2)生成3.94g沉淀是碳酸钡,根据碳守恒,求出二氧化碳的体积;
(3)据图象数据,再计算出其物质的量之比,然后结合碳酸钠的物质求出氢氧化钠,根据组成守恒来求解;
(4)由原子守恒可以求出NaHCO3和Na2O2的固体混合物中各成份的量.
解答 解:(1)由图象可知,因为175>275-175所以固体混,合物为NaOH,Na2CO3,故答案为:NaOH,Na2CO3;
(2)生成3.94g沉淀是碳酸钡,n(CO2)=n(BaCO3)=$\frac{3.94g}{197g/mol}$=0.02mol,所以V=0.02mol×22.4L/mol=0.448L,故答案为;0.448;
(3)由175ml到275ml是与碳酸氢钠反应,而n(Na2CO3)=n(NaHCO3)=n(CO2)=0.02mol,
NaHCO3~~~HCl
1mol 1mol
0.02mol 0.02mol
所以C(HCl)=$\frac{0.02mol}{(275-175)×1{0}^{-3}L}$=0.2mol/L,故答案为:0.2mol/L;
(4)根据碳守恒可知,n(NaHCO3)=n(CO2)=0.02mol×2=0.04mol,m(NaHCO3)=0.04mol×84g/mol=3.36g,根据钠守恒可知n(Na2O2)=$\frac{0.2mol/L×275ml×1{0}^{-3}L/ml×2-0.04mol}{2}$=0.035mol,m(Na2O2)=0.035mol×78g/mol=2.73g,故答案为:3.36g,2.73g.
点评 本题考查了过氧化钠、碳酸氢钠的性质及混合物组成的计算,题目难度中等,注意掌握过氧化钠、碳酸氢钠的性质及根据化学方程式进行的简单计算方法,本题中分析、理解图象信息是解题关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解质溶液导电的过程实际上就是电解的过程 | |
| B. | 利用电解饱和食盐水所得的产物可以生产盐酸 | |
| C. | 铜在酸性环境中易发生析氢腐蚀 | |
| D. | 氢氧燃料电池的负极通入的是氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | b极为电池的负极 | |
| B. | 当1mol乙醇被氧化转移12NA个电子 | |
| C. | 电池工作时电流由a极沿导线经灯泡再到b极 | |
| D. | 电池正极的电极反应为:O2+4e-+2H2O=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 35.6% | B. | 27% | C. | 10% | D. | 73% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使苯酚显紫色的溶液:NH4+、K+、SCN-、NO3- | |
| B. | 加入铝粉产生氢气的溶液:Na+、K+、NO3-、Cl- | |
| C. | 澄清透明的溶液中:SO42-、K+、Cu2+、Cl- | |
| D. | 由水电离出的c(H+)•c(OH-)=10-22的溶液:Fe2+、Na+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在化学反应过程中,发生物质变化的同时不一定发生能量变化 | |
| B. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,则表示氢气燃烧热的热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | |
| C. | 温度、浓度的改变一定会引起反应速率的改变,所以化学平衡一定会移动 | |
| D. | 酸与碱恰好完全反应生成正盐,其中c(H+)=c(OH-)=10-6 mol/L的溶液一定呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,B
,B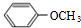 ,C
,C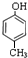 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com