
| A. | 冰融化时,分子中氢氧键发生断裂 | |
| B. | 原子晶体中共价键越强,熔点和沸点越高 | |
| C. | 分子晶体中共价键键能越大,该分子晶体的熔点和沸点一定也越高 | |
| D. | 分子晶体中分子间作用力越大,该物质越稳定 |
分析 A.冰中存在分子间作用力;
B.原子晶体中共价键的强弱决定其熔点的高低;
C.分子晶体的熔点和沸点与分子之间的作用力有关,与分子内的共价键的键能无关;
D.分子间作用力只影响晶体的物理性质,与其稳定性无关.
解答 解:A.冰中存在分子间作用力,所以冰融化时克服分子间作用力,共价键不变,故A错误;
B.原子晶体中共价键的强弱决定其熔点的高低,所以原子晶体中共价键越强,熔点越高,故B正确;
C.分子晶体的熔点和沸点与分子之间的作用力有关,与分子内的共价键的键能无关,故C错误;
D.分子间作用力只影响晶体的物理性质,与其稳定性无关,晶体中分子间作用力越大,其熔沸点越大,故D错误;
故选B.
点评 本题考查不同类型晶体及其化学键、物质的性质,明确晶体的构成粒子、晶体类型即可解答,题目难度不大.


 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:选择题
| 50ml盐酸 | 50ml盐酸 | 50ml盐酸 | |
| m(混合物) | 9.2g | 13.8g | 27.6g |
| V(CO2)(标况) | 2.24L | 3.36L | 3.36L |
| A. | 13.8g混合物恰好能与50ml盐酸完全反应 | |
| B. | 根据表中数据不能计算出混合物中NaHCO3的质量分数 | |
| C. | 向50ml盐酸中加入混合物27.6g时,盐酸过量 | |
| D. | 盐酸的物质的量浓度为5.0mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吸热反应 | B. | 放热反应 | ||
| C. | 熵减反应 | D. | 熵增效应大于能量效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
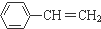 的下列叙述中,不正确的是( )
的下列叙述中,不正确的是( )| A. | 苯乙烯可以发生加聚反应 | |
| B. | 等质量苯和苯乙烯充分燃烧生成CO2的物质的量相等 | |
| C. | 苯乙烯和氢气按1:3加成 | |
| D. | 苯乙烯中所有的原子有可能都在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com