
| A、乙醇和丙三醇互为同系物 |
| B、16gCH4和18gNH4+所含的质子数相等 |
| C、32S和33S的核外电子数相等,属于同一种核素 |
| D、质量相等,体积不等的CO和C2H4的分子数相等 |
| m |
| M |


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
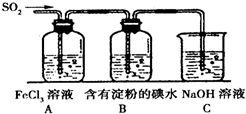 为探究SO2气体的还原性某兴趣小组设计了如装置图:
为探究SO2气体的还原性某兴趣小组设计了如装置图:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 可经三步反应制取
可经三步反应制取  ,发生反应的类型依次是( )
,发生反应的类型依次是( )| A、水解反应、加成反应、氧化反应 |
| B、加成反应、水解反应、氧化反应 |
| C、水解反应、氧化反应、加成反应 |
| D、加成反应、氧化反应、水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、A的分子式为:C14H13O5N2 |
| B、A可以发生水解反应、中和反应、加成反应、消去反应 |
| C、A物质完全水解的产物中,一定含有醇类 |
| D、在一定条件下,1molA最多能与1L 2mol?L-1NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生成的氢气中只含有H2 |
| B、生成的氢气中只含有D2 |
| C、生成的氢气中含有H2、HD、D2 |
| D、以上判断都不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Br-、Fe2+、I- |
| B、Br-、I-、Fe2+ |
| C、I-、Fe2+、Br- |
| D、Fe2+、I-、Br- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com