
【题目】Ⅰ. (1)用锌片,铜片连接后浸入稀硫酸溶液中,构成了原电池,工作一段时间,锌片的质量减少了3.25g,铜表面析出了氢气________L(标准状况下),导线中通过________mol电子。
(2) 将ag Na投入到bg D2O(足量)中,反应后所得溶液的密度为dg/cm3,则该溶液物质的量浓度是_______;
Ⅱ. 将气体A、B置于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)2C(g)+2D(g)。反应进行到10 s末时,测得A的物质的量为1.8 mol,B的物质的量为0.6 mol,C的物质的量为0.8 mol,则:
(1)用C表示10 s内正反应的平均反应速率为____________。
(2)反应前A的物质的量浓度是________。
(3)10 s末,生成物D的浓度为________。
【答案】1.12 0.1 ![]() mol/L 0.04molL-1s-1 1.5molL-1 0.4molL-1
mol/L 0.04molL-1s-1 1.5molL-1 0.4molL-1
【解析】
Ⅰ.(1)用锌片、铜片连接后浸入稀硫酸溶液中,构成了原电池,锌为负极,电极反应为:Zn-2e-=Zn2+,铜为正极,电极反应为2H++2e-=H2↑,锌片的质量减少了3.25克,则物质的量为![]() =0.05mol,转移的电子的物质的量为n(e-)=2n(Zn)=2n(H2)=2×0.05mol=0.1mol,则V(H2)=0.05mol×22.4L/mol=1.12L,故答案为:1.12;0.1;
=0.05mol,转移的电子的物质的量为n(e-)=2n(Zn)=2n(H2)=2×0.05mol=0.1mol,则V(H2)=0.05mol×22.4L/mol=1.12L,故答案为:1.12;0.1;
(2)将ag Na投入到bg D2O(足量)中,发生2Na+2D2O=2NaOD+D2↑,ag Na的物质的量为![]() =
=![]() mol,生成的氢氧化钠为
mol,生成的氢氧化钠为![]() mol,D2的物质的量为
mol,D2的物质的量为![]() mol,质量为
mol,质量为![]() mol×4g/mol=
mol×4g/mol=![]() g,反应后溶液的质量为ag+bg-
g,反应后溶液的质量为ag+bg-![]() g=(a+b-
g=(a+b-![]() )g,溶液的体积为
)g,溶液的体积为 =
=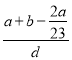 cm3,则该溶液物质的量浓度c=
cm3,则该溶液物质的量浓度c=![]() =
= =
=![]() mol/L,故答案为:
mol/L,故答案为:![]() mol/L;
mol/L;
Ⅱ.(1)v(C)= =0.04molL-1s-1,故答案:0.04molL-1s-1;
=0.04molL-1s-1,故答案:0.04molL-1s-1;
(2)3A(g)+B(g)2C(g)+2D(g)。反应进行到10 s末时,测得A的物质的量为1.8 mol,C的物质的量为0.8 mol,则反应的A为1.2mol,反应前A的物质的量浓度是![]() =1.5molL-1,故答案为:1.5molL-1;
=1.5molL-1,故答案为:1.5molL-1;
(3)3A(g)+B(g)2C(g)+2D(g)。反应进行到10 s末时,测得C的物质的量为0.8 mol,则生成的D为0.8 mol ,10 s末,生成物D的浓度为![]() =0.4molL-1,故答案为:0.4molL-1。
=0.4molL-1,故答案为:0.4molL-1。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、P为短周期的主族元素,其原子序数依次增大。Y、Z、W、P位于同一周期。X元素形成的单质是自然界中含量最多的气体,1 mol Y的单质分别与足量盐酸和氢氧化钠溶液反应生成的气体在标准状况下均为33.6 L。W的原子最外层电子数与核外电子总数之比为3∶8,X的原子序数是Z的原子序数的一半。
(1)Z的原子结构示意图为________,W与P可形成原子个数比为1∶2的化合物,其电子式为____________。
(2)经测定,在2.5×1.01×105 Pa下,Y 与P形成的化合物的熔点为190 ℃,沸点为180 ℃,则该化合物为________晶体。
(3)Z、W、P三种元素的气态氢化物稳定性由高到低的顺序是____________________(填化学式)。
(4)Y与W形成的化合物遇水分解,发生反应的化学方程式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无土栽培中需用浓度为0.5mol/L NH4Cl、0.16mol/L KCl、0.24mol/L K2SO4的培养液,若用KCl、NH4Cl和(NH4)2SO4三种物质来配制1.00L上述营养液,所需三种盐的物质的量正确的是( )
A.0.4mol、0.5mol、0.12molB.0.66mol、0.5mol、0.24mol
C.0.64mol、0.5mol、0.24molD.0.64mol、0.02mol、0.24mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如右图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:Z>W>X
C. 四种元素的单质中,Z单质的熔、沸点最低
D. W的单质能与水反应,生成一种具有漂白性的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验是化学的基础。某实验小组用下列装置进行乙醇的催化氧化实验。

(1)实验过程中铜网交替出现红色和黑色,请写出相应的化学方程式:
①____________;②______________。
(2)甲和乙两个水浴作用不相同。甲的作用是加热使乙醇挥发;乙的作用是____________。
(3)反应进行一段时间后,试管a中能收集到不同的有机物质,它们是__________;集气瓶中收集的气体主要成分是________。铜网的作用是____________;
(4)实验室可用乙醇来制取乙烯,将生成的乙烯通入溴的四氯化碳溶液,反应后生成物的结构简式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)= C4H8(g) + H2(g) ΔH1已知:②C4H10(g) +![]() O2(g)= C4H8(g) + H2O(g) ΔH2=-119 kJ·mol-1③H2(g) +
O2(g)= C4H8(g) + H2O(g) ΔH2=-119 kJ·mol-1③H2(g) + ![]() O2(g)= H2O(g) ΔH3=-242kJ·mol-1.反应①的ΔH1为_____ kJ·mol-1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x_______0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是_____(填标号)。
O2(g)= H2O(g) ΔH3=-242kJ·mol-1.反应①的ΔH1为_____ kJ·mol-1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x_______0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是_____(填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强

(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是______________________。
(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。590 ℃之后,丁烯产率快速降低的主要原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无论在办公室还是居室里,在漂亮的花瓶中插上一束美丽的鲜花,将会给紧张而又忙碌的工作、生活带来轻松和愉悦的心情。如果在花瓶中加入“鲜花保鲜剂”,就会延长鲜花的寿命。下表是1 L“鲜花保鲜剂”的成分,阅读后回答下列问题:

(1)“鲜花保鲜剂”中物质的量浓度最大的成分是________(填写名称)。
(2)“鲜花保鲜剂”中K+的物质的量浓度为(阿司匹林不含K+)________mol·L-1(只要求写表达式,不需计算)。
(3)配制过程中,下列操作对配制结果没有影响的是________(填字母)。
A.容量瓶在使用前未干燥,里面有少量蒸馏水
B.定容时仰视液面
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(4)欲确定“鲜花保鲜剂”中硝酸银的浓度,则加入的试剂中应含有________(填化学符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是

A.O点溶液中所含溶质的化学式为NaOH、Na2CO3
B.a点溶液中c (HCO3-) > c (CO32-)
C.标准状况下,通入CO2的体积为44.8L
D.原NaOH溶液的物质的量浓度为5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是( )
A.若A(g)+B(g)![]() C(g)△H<0,则正反应的活化能小于逆反应的活化能
C(g)△H<0,则正反应的活化能小于逆反应的活化能
B.制备乙酸乙酯时可用热的NaOH溶液收集产物以除去其中的乙酸
C.甲烷和氯气反应与苯和硝酸反应生成硝基苯的反应类型相同
D.已知某温度下Ksp(Ag2S)=6×10一50,Ksp(AgC1)═2×l0一10,则2AgCl(s)+S2﹣(aq)![]() Ag2S(s)+2C1﹣(aq)的平衡常数约为6.7×1029
Ag2S(s)+2C1﹣(aq)的平衡常数约为6.7×1029
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com