
燃烧1.00t含硫质量分数为48.0%的黄铁矿矿石,若在生产过程中,黄铁矿的利用率为90.0%,硫酸的产率为85.0%,且还有质量分数为1.50%的硫留在炉渣里.试计算能够生产多少吨H2SO4质量分数为98.0%的硫酸.
 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源:新课标 教材全解 高中化学 配人教版(必修1) 人教版 题型:038
某工厂每天要燃烧100 t含硫质量分数为1.6%的煤,为防止污染空气,用石灰乳吸收SO2气体,同时通入氧气最终使SO2转化为石膏(CaSO4·2H2O),试计算理论上每天可生产石膏物质的量.
查看答案和解析>>
科目:高中化学 来源: 题型:
A.4FeS2(s)+11O2(g)====2Fe2O3(s)+8SO2(g) ΔH=+853.7 kJ·mol-1
B.FeS2(s)+11/4O2(g)====1/2Fe2O3(s)+2SO2(g) ΔH=-853.7 kJ·mol-1
C.4FeS2(s)+11O2(g)====2Fe2O3(s)+8SO2(g) ΔH=+3 414.8 kJ·mol-1
D.FeS2(s)+11/4O2(g)====1/2Fe2O3(s)+2SO2(g) ΔH=-3 414.8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
A.FeS2(s)+![]() O2 (g)====
O2 (g)====![]() Fe2O3(s)+2SO2 (g);ΔH=-853.7kJ/mol
Fe2O3(s)+2SO2 (g);ΔH=-853.7kJ/mol
B.4FeS2(s)+11O2 (g)====2Fe2O3(s)+8SO2 (g);ΔH=+853.7 kJ/mol
C.4FeS2(s)+11O2 (g)====2Fe2O3(s)+8SO2 (g);ΔH=+3 414.8 kJ/mol
D.FeS2(s)+![]() O2 (g)====
O2 (g)====![]() Fe2O3(s)+2SO2 (g);ΔH=-3 414.8 kJ/mol
Fe2O3(s)+2SO2 (g);ΔH=-3 414.8 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)工业接触法制硫酸的生产中用到的设备有:①沸腾炉、②________________、③吸收塔,写出在设备②中,发生的主要反应的化学方程式:________________________。
(2)已知SO2转化为SO3的反应为放热反应,下图中正确的是______________(填序号)。
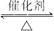
(3)在吸收塔中,为了提高SO3的吸收率,工业上选择的吸收剂是___________(填序号)。
A.H2O B.稀H2SO
(4)在101 kPa时,燃烧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com