
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
| 名称 | 甲烷 | 一氧化碳 | 乙烯 | 苯 | 甲苯 | 苯酚 | 氨水 |

 、
、 .
. .
. 分析 (1)有机物是指含有碳元素的化合物,无机物是指不含有碳元素的化合物.但是一氧化碳、二氧化碳、碳酸盐等物质中虽然含有碳元素,这些物质的性质和无机物相似,把它们归入无机物;苯酚俗称石炭酸;
(2)乙烯中含有碳碳双键能够与溴水发生加成反应;
(3)能发生加聚反应说明该有机物中含有双键或者三键,只有乙烯符合结构特点,乙烯聚合生成聚乙烯塑料,可用于食品包装;
(4)具有还原性的物质能被酸性高锰酸钾溶液氧化,含有碳碳不饱和键、醛基及连接苯环的碳原子上含有氢原子的苯的同系物都能被酸性高锰酸钾溶液氧化而使其褪色;
(4)根据结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物,结构相似是指物质种类相同,若含有官能团,官能团的种类与数目相同;
(5)甲苯有四种不同环境下的氢原子:甲基上1种,苯环上3种.
解答 解:(1)氨水中不含碳元素,属于无机物;一氧化碳虽然含有碳元素但是性质和无机物相似,属于无机物;苯酚俗称石炭酸,故答案为:②⑦;石炭酸;
(2)乙烯中含有碳碳双键能够与溴水发生加成反应,能与溴水反应使之褪色,故答案为:③;
(3)乙烯含有碳碳双键能发生加聚生成聚氯乙烯,可用于食品包装,反应的方程式为:nCH2=CH2$\stackrel{催化剂}{→}$ ,
,
故答案为:③;nCH2=CH2$\stackrel{催化剂}{→}$ ;
;
(4)CH2=CH2; ;
; 能使酸性高锰酸钾褪色,故答案为:CH2=CH2;
能使酸性高锰酸钾褪色,故答案为:CH2=CH2; ;
; ;
;
(4)苯和甲苯结构相似,在分子组成上相差一个CH2原子团,互称为同系物,故答案为:④⑤;
(5)氢分子中一氯代物的种数等于不同环境下氢原子的种数,甲苯有四种不同环境下的氢原子:甲基上1种,苯环上3种,所以甲苯有4种一氯代物: ,
,
故答案为:4; .
.
点评 本题考查了常见有机物的结构和性质,属于对课本基础知识的考查,题目难度不大,熟悉物质的结构和性质是解题的关键.


科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 最外层电子数比次外层电子数少5个电子 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 试剂 | T1/℃ | T2/℃ | T3/℃ |
| NaCO3 | 23.3 | 20.0 | 23.7 |
| NaHCO3 | 18.5 | 20.0 | 20.8 |
| 温度 溶解度 | 10℃ | 20℃ | 30℃ | 40℃ |
| NaCO3 | 12.5g | 21.5g | 39.7g | 40.0g |
| NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
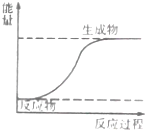
| A. | 如图表示化学反应过程中释放能量 | |
| B. | 化学反应中有物质变化也有能量变化 | |
| C. | 化学反应中一定存在化学键的变化 | |
| D. | 原电池是将化学能转变成电能的装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
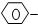 、-COOH 4种基团两两组合而成的有机物中,能跟NaOH溶液发生化学反应的有( )
、-COOH 4种基团两两组合而成的有机物中,能跟NaOH溶液发生化学反应的有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 和
和 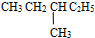 ⑤
⑤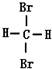 和
和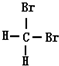
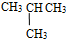 ⑦C2H5OH和C4H9OH
⑦C2H5OH和C4H9OH查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 储氢材料的种类很多,包括储氢合金、配位氢化物、碳质吸附材料等.
储氢材料的种类很多,包括储氢合金、配位氢化物、碳质吸附材料等.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com