
| A�� | �٢ڢ� | B�� | �٢ۢ� | C�� | �ۢݢ� | D�� | �ڢܢ� |
���� ��ǿ��ϡ��ʱ������Ũ�ȼ�С��ˮ�����ӻ����䣬������������Ũ������
��笠����ӵ�Ũ��Խ��ˮ��̶�ԽС��
����ͬŨ��ʱ����Խǿ����pH��ͬʱ����Һ��Ũ��ԽС��
��PH=8.3��˵��ˮ����ڵ��룻
��pH=2��һԪ�����Ϊǿ��Ҳ���������
��pH=4Ũ�Ⱦ�Ϊ0.1mol•L-1��CH3COOH��CH3COONa�����Һ�У��������ˮ�⣮
��� �⣺��ǿ����Һȫ�����룬��ˮϡ�ͺ���Һ��H+����Ũ�Ƚ��ͣ������Ӻ������������ӵ�Ũ�ȵij˻���ˮ�����ӻ���Ϊ��ֵ����������������Ũ�����ʢٴ���
��笠����ӵ�Ũ��Խ����ˮ��̶�ԽС����1L 0.50mol•L-1 NH4Cl��Һ��2L 0.25mol•L-1 NH4Cl��Һ��NH4+���ʵ�������ȣ�ǰ�ߴ��ں��ߣ��ʢڴ���
�������ε�ˮ��Һ���Լ��ԣ�ͬŨ��ʱ����ǿ��˳��Ϊd��b��c��a����pH��ȵ�������Һ���ʵ���Ũ����С����˳��Ϊd��b��c��a���ʢ���ȷ��
��pH=8.3����Һ�ʼ��ԣ�˵��ˮ����ڵ��룬ˮ������H2CO3���������CO32-�������Ӳ�ˮ�⣬HCO3-�������������ƣ����������ƶ���������������Ũ�ȴ�С˳��Ϊ��c��Na+����c��HCO3-����c��H2CO3����c��CO32-�����ʢܴ���
��pH=2��һԪ�����Ϊǿ��Ҳ���������ᣬǿ������ԣ���������ԣ���Ӧ��Ļ��Һ�е�c��OH-����c��H+�����ʢ���ȷ��
��pH=4Ũ�Ⱦ�Ϊ0.1mol•L-1��CH3COOH��CH3COONa�����Һ�У��������ˮ�⣬c��Na+����c��CH3COOH��������غ�c��CH3COO-��+c��OH-��=c��Na+��+c��H+������c��CH3COO-��+c��OH-����c��CH3COOH��+c��H+�����ʢ���ȷ��
���ݷ�����֪����ȷ��Ϊ�ۢݢޣ�
��ѡC��
���� ���⿼������Ũ�ȴ�С�Ƚϣ��漰������ʵĵ��롢pH�ļ��㡢�����ˮ���Լ�����ϵĶ����жϺͼ��㣬��Ŀ�Ѷ��еȣ�ע������������ʵĵ���ƽ�⼰��Ӱ�죬��ȷ����غ㡢�����غ㼰�ε�ˮ��ԭ�����ж�����Ũ�ȴ�С�е�Ӧ�÷�����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
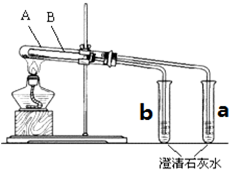 Ϊ̽��̼���ƺ�̼�����ƹ�������ȶ��ԣ�ijͬѧ����ˡ���ʵ�顱��װ����ͼ�����Թ�A��С�Թ�a����ͨ�����Թ�BС�Թ�b����ͨ��
Ϊ̽��̼���ƺ�̼�����ƹ�������ȶ��ԣ�ijͬѧ����ˡ���ʵ�顱��װ����ͼ�����Թ�A��С�Թ�a����ͨ�����Թ�BС�Թ�b����ͨ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | c��Na+��=c��CH3COO-�� | B�� | pH��7 | C�� | pH=7 | D�� | pH��7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
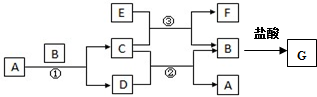
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 25��ʱ�������ĵ��볣��Ka=6.8��10-4mol•L-1������ĵ��볣��Ka=1.8��10-5mol•L-1����ͼ��ʾ25��ʱ�����ƺʹ�������Һ��Ũ�Ⱥ�Y�Ĺ�ϵ����Y���Ա�ʾ��������
25��ʱ�������ĵ��볣��Ka=6.8��10-4mol•L-1������ĵ��볣��Ka=1.8��10-5mol•L-1����ͼ��ʾ25��ʱ�����ƺʹ�������Һ��Ũ�Ⱥ�Y�Ĺ�ϵ����Y���Ա�ʾ��������| A�� | ��Һ��pH | B�� | ˮ��ƽ�ⳣ�� | ||
| C�� | ˮ��ٷ��� | D�� | ��Һ��������Ũ��֮�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ˮ��������ΪҺ̬��ˮ | B�� | �������Ȼ��ⷴӦ�����Ȼ�茶��� | ||
| C�� | ̼������ڳ�������·ֽ� | D�� | CO��ȼʱ����CO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��֪ˮ��25���95��ʱ�������ƽ��������ͼ��ʾ��
��֪ˮ��25���95��ʱ�������ƽ��������ͼ��ʾ���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com